
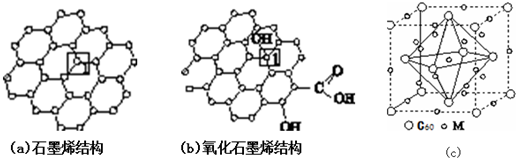
| A. | 按熔点由低到高排列I2、CO2、Hg、KCl、SiO2 | |
| B. | 在石英晶体中,每个硅原子和相邻的两个氧原子以共价键结合 | |
| C. | 有机物分子中碳原子成键方式和排列方式有多种以及同分异构现象的存在都是有机物种类繁多的原因 | |
| D. | 因为石墨是金刚石的同素异形体,所以二者空间结构相似,化学性质相似 |
分析 A.晶体熔沸点:原子晶体>离子晶体>分子晶体,不含氢键的分子晶体熔沸点与其相对分子质量成正比;
B.在石英晶体中,每个Si原子和四个O原子相连,每个O原子和两个Si原子相连;
C.碳原子能形成四个共价键,且碳原子和其它非金属元素及自身能形成共价键,形成的碳链结构有直链状、环状;
D.同素异形体化学性质相似,物理性质不同.
解答 解:A.晶体熔沸点:原子晶体>离子晶体>分子晶体,不含氢键的分子晶体熔沸点与其相对分子质量成正比,I2、CO2为分子晶体,Hg为金属晶体,KCl为离子晶体,SiO2为原子晶体,所以熔沸点SiO2>KCl>I2>Hg>CO2,故A错误;
B.在石英晶体中,每个Si原子和四个O原子相连,每个O原子和两个Si原子相连,故B错误;
C.碳原子能形成四个共价键,且碳原子和其它非金属元素及自身能形成共价键,形成的碳链结构有直链状、环状,所以有机物分子中碳原子成键方式和排列方式有多种以及同分异构现象的存在都是有机物种类繁多的原因,故C正确;
D.同素异形体化学性质相似,物理性质不同,金刚石为空间网状结构、石墨为层状结构,故D错误;
故选C.
点评 本题考查晶体熔沸点比较、碳的成键特点、同素异形体等知识点,为高频考点,侧重考查学生对物质结构、性质的比较判断,注意A中Hg晶体熔沸点,为易错点.


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:选择题
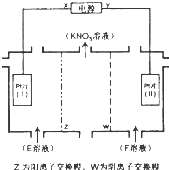
| A. | X为负极,F溶液NaNO3溶液 | |
| B. | 电解一段时间,往Pt片(I)附近滴入酚酞,溶液变红 | |
| C. | 电解总反应方程式为:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | |
| D. | 理论上,当得到0.1molKNO3时,Pt片(Ⅱ)上生成标准状况下为1.12L的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
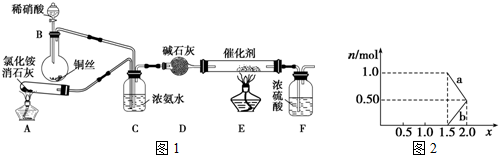
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | BaCl2与K2CO3溶液反应 | B. | CO2与Ba(OH)2溶液反应 | ||
| C. | Ba(NO3)2与Na2CO3溶液反应 | D. | Ba(OH)2与少量NaHCO3溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:Mg2+、Al3+、NO3-、Cl- | |
| B. | 使pH试纸显蓝色的溶液中:NH4+、NO3-、SO42-、Na+ | |
| C. | 由水电离的c(H+)=1×10-14mol•L-1的溶液中:Mg2+、K+、Cl-、NO3- | |
| D. | pH=0的溶液中:K+、Fe3+、SO42-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
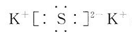 ,A属于离子化合物.
,A属于离子化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .其基态原子有7种能量不同的电子;
.其基态原子有7种能量不同的电子;
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
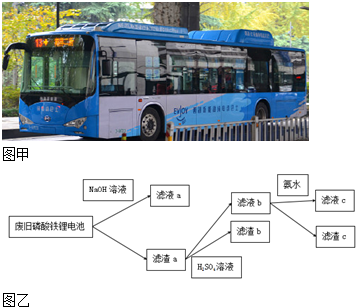
| A. | 向滤液a中加入适量H2SO4溶液,可以得到白色沉淀 | |
| B. | 滤液b中加入氨水的目的是使Fe3+沉淀,滤渣c为红褐色 | |
| C. | 要将Li从溶液中析出,可在滤液c中加入足量Na2CO3溶液,加热浓缩,冷却结晶 | |
| D. | 图中的氨水可以用适量NaOH溶液代替 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图(d)所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60
)是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图(d)所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60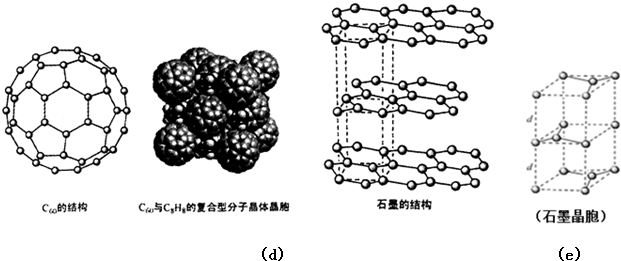
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com