
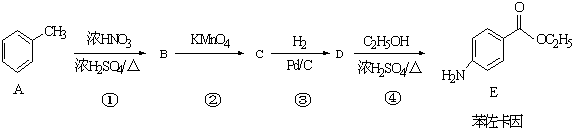
 .
. +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$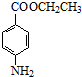 +H2O
+H2O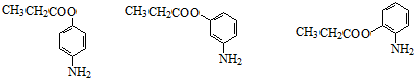 (其中一种)(任写一种)
(其中一种)(任写一种) )的合成路线图(其他原料任选).
)的合成路线图(其他原料任选). 分析 根据题中各物转化关系,结合苯佐卡因的结构可知,甲苯发生硝化反应生成B为 ,B发生氧化反应生成C为
,B发生氧化反应生成C为
 ,D发生酯化反应生成E.
,D发生酯化反应生成E.
解答 解:根据题中各物转化关系,结合苯佐卡因的结构可知,甲苯发生硝化反应生成B为 ,B发生氧化反应生成C为
,B发生氧化反应生成C为
 ,D发生酯化反应生成E.
,D发生酯化反应生成E.
(1)根据上面的分析可知,B为 ,分子式为C7H7NO2,C的结构简式为
,分子式为C7H7NO2,C的结构简式为
故答案为:C7H7NO2;
(2)反应②的反应类型为氧化反应,故答案为:氧化反应;
(3)反应④为酯化反应,化学方程式为: +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$ +H2O,
+H2O,
故答案为: +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$ +H2O;
+H2O;
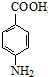
(4)根据苯佐卡因的结构简式可知,其核磁共振氢谱中有5个峰,故答案为:5;
(5)苯佐卡因有多种同分异构体,除苯佐卡因外,符合下列条件:①含苯环且氨基直接与苯环相连;②苯环上有两个取代基;③含酯基,符合条件的苯佐卡因的同分异构体为苯环连有-NH2和-C3H5O2基团,-C3H5O2基团且是酯基的结构有-OOCCH2CH3、-CH2OOCCH3、-CH2CH2OOCH、-CH(CH3)OOCH、-COOCH2CH3、-CH2COOCH3,它们与氨基都有互为邻、间、对三种位置位置关系,所以共有18种结构,除了苯佐卡因外,有17种,其中能与NaOH溶液反应生成2种钠盐的同分异构体的结构简式为 ,
,
故答案为:17; (其中一种);
(其中一种);
(6)苯与溴在Fe作催化剂条件下得到溴苯,再与氢气发生加成反应得到一溴环己烷,最后再氢氧化钠水溶液、加热条件下得到 ,合成路线流程图为:
,合成路线流程图为: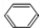 $\stackrel{Br_{2}/Fe}{→}$
$\stackrel{Br_{2}/Fe}{→}$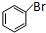 $→_{△}^{氢氧化钠水溶液}$
$→_{△}^{氢氧化钠水溶液}$ ,
,
故答案为: $\stackrel{Br_{2}/Fe}{→}$
$\stackrel{Br_{2}/Fe}{→}$ $→_{△}^{氢氧化钠水溶液}$
$→_{△}^{氢氧化钠水溶液}$ .
.
点评 本题主要考查有机物推断与合成、限制条件同分异构体书写等,注意根据有机物的结构与反应条件进行推断,熟练掌握官能团的性质与转化,(5)中同分异构体为易错点.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:解答题
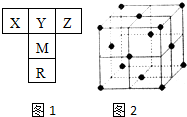 如图1是元素周期表的一部分.已知R的核电荷数小于36,气态氢化物沸点:MHn>YHn.
如图1是元素周期表的一部分.已知R的核电荷数小于36,气态氢化物沸点:MHn>YHn.
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
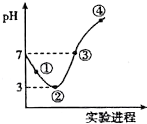 常温下,将Cl2缓慢通入100mL水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol/L NaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )
常温下,将Cl2缓慢通入100mL水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol/L NaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )| A. | 用pH试纸测①处c(H+)约为②处c (H+)的两倍 | |
| B. | 可依据②处数据计算所溶解的n(Cl2) | |
| C. | ③处表示溶液中,c(Na+)=c(ClO-)+c(Cl-) | |
| D. | 曲线③④段有离子反应:HClO+OH-→ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解得到的汽油是纯净物 | |
| B. | 石油分馏和煤干馏都是物理变化 | |
| C. | 煤干馏可以得到甲烷、苯和氨等重要化工原料 | |
| D. | 水煤气是通过煤的液化得到的气体燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l);△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ | |
| C. | 由C(石墨)=C(金刚石)△H=+1.90 kJ/mol可知石墨比金刚石稳定 | |
| D. | 在101 kPa时,2 g H2 完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(g)△H=-571.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
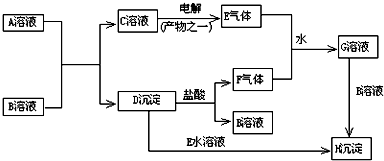
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙溶于醋酸CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 澄清石灰水中加入盐酸Ca(OH)2+2H+═Ca2++2H2O | |
| C. | 铜片加入稀硝酸中3Cu+2NO3-+8H+═3Cu2++2N0↑+4H20 | |
| D. | 小苏打溶液和盐酸混合CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
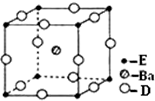 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍.E有“生物金属”之称,E4+和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍.E有“生物金属”之称,E4+和氩原子的核外电子排布相同.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com