
【题目】常温下,用0.1mol·L-1NaOH溶液滴定新配制的25.0mL0.02 mol·L-1FeSO4溶液,应用手持技术测定溶液的pH与时间(t)的关系,结果如右图所示。下列说法错误的是
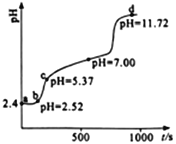
A. ab段,溶液中发生的主要反应:H++OH-=H2O
B. bc段,溶液中c(Fe2+) > (Fe3+) >c(H+)>c(OH-)
C. d点,溶液中的离子主要有Na+、SO42-、OH-
D. 滴定过程发生了复分解反应和氧化还原反应
【答案】B
【解析】A、ab段,新配制的25.0mL0.02 mol·L-1FeSO4溶液,为抑制水解加了些硫酸,溶液中发生的主要反应:H++OH-=H2O,故A正确;B. bc段,c(H+)> (Fe3+) ,故B错误;C.d点 pH =11.72,表示滴定反应已完全结束, 此时溶液含有硫酸钠与过量的氢氧化滴定反应已完全结束, 此时溶液含有硫酸钠与过量的氢氧化滴定反应已完全结束, 此时溶液含有硫酸钠与过量的氢氧化钠,溶液中的离子主要有 Na+、SO42-、OH-,C正确;D、 滴定过程中发生的反应有酸碱中和反应、硫酸亚铁与氢氧化钠的复分解反应、氢氧化亚铁与氧气的氧化还原反应,故D正确。


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
【题目】食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐中常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-,选出a所代表的试剂,按滴加顺序依次为________(只填化学式)。
②分离操作①中所用到的玻璃仪器有____________。
③洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为________。
(2)用提纯的NaCl配制450 mL 4.00 mol·L-1NaCl溶液,所用仪器除药匙、烧杯、玻璃棒外还有________(填仪器名称)。
(3)在实验中多次用到玻璃棒,其作用有三个,分别是______________、______________、______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.由非金属元素组成的化合物不一定是共价化合物
B.离子化合物中一定不存在共价键
C.共价化合物中可能含有离子键
D.非极性键只存在于双原子单质分子里
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过二硫酸钾(K2S2O8) 在科研与工业上有重要用途。
(1)S2O82-的结构式为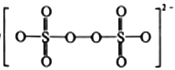 ,其中S元素的化合价为_________________。在Ag+催化下,S2O82-能使含Mn2+的溶液变成紫红色,氧化产物是___________(填离子符号)。
,其中S元素的化合价为_________________。在Ag+催化下,S2O82-能使含Mn2+的溶液变成紫红色,氧化产物是___________(填离子符号)。
(2)某厂采用湿法K2S2O8氧化脱硝和氨法脱硫工艺综合处理锅炉烟气,提高了烟气处理效率,处理液还可以用作城市植被绿化的肥料。
①脱硫过程中,当氨吸收液的pH=6时,n(SO32-)∶n(HSO3-) =________。
[巳知:25℃时,Ka1(H2SO3)=1.5×10-2,K a2(H2SO3)=1.0×10-7]
②脱硝过程中依次发生两步反应:第1步,K2S2O8将NO氧化成HNO2,第2步,K2S2O8继续氧化HNO2,第2步反应的化学方程式为______________________________________;
一定条件下,NO去除率随温度变化的关系如右图所示。80℃时,若NO初始浓度为450mg·m-3,t min达到最大去除率,NO去除的平均反应速率:
v(NO) =____mol·L-1·min-1(列代数式)
(3)过二硫酸钾可通过“电解→转化→提纯”方法制得,电解装置示意图如右图所示。
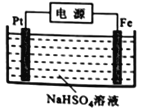
①电解时,铁电极连接电源的_________________极。
②常温下,电解液中含硫微粒的主要存在形式与pH的关系如下图所示。
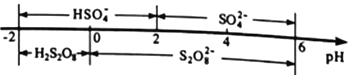
在阳极放电的离子主要是HSO4-,阳极区电解质溶液的pH范围为_________,阳极的电极反应式为________________________。
③往电解产品中加入硫酸钾,使其转化为过二硫酸钾粗产品,提纯粗产品的方法_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛及其化合物的应用正越来越受到人们的关注。
(1)基态下原子核外电子排布的最高能级的符号是_____________。与钛同周期的元素中,基态原子的未成对电子数与钛相同的有_____种。
(2)钛比钢轻、比铝硬,是一种新兴的结构材料。钛硬度比铝大的原因是________________________。
(3)TiCl4是氯化法制取钛的中间产物。TiCl4和SiCl4在常温下都是液体,分子结构相同。采用蒸馏的方法分离SiCl4和TiCl4的混合物,先获得的馏分是______________(填化学式)。
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯等的聚合,其结构如右图所示。
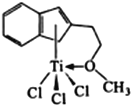
①组成该物质的元素中,电负性最大的是____________ (填元素名称)。
②M中,碳原子的杂化形式有________种。
③M中,不含_________(填标号)。
a. π键 b. σ键 c.配位键 d.氢键 e.离子键
(5)金红石(TiO2)是含钛的主要矿物之一,具有四方晶系结构。其晶胞结构(晶胞中相同位置的原子相同)如下图所示。
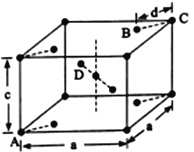
①4个微粒A、B、C、D中,属于氧原子的是______________。
②若A、B、C的原子坐标分别为A (0,0,0)、B (0.69a,0.69a,c)、c (a, a,c),则D的原子坐标为D (0.19a,_____,______);钛氧键的键长d=________________(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以绿矾(FeSO47H2O)为原料制备化合物A[K3Fe(Ⅲ) (C2O4)xyH2O]并通过如下实验步骤确定A的化学式:
步骤1:准确称取A样品4.91g,干燥脱水至恒重,残留物质量为4.37g;
步骤2:将步骤1所得固体溶于水,经测定含Fe3+0.0l00mol;
步骤3:准确称取A样品4.91g置于锥形瓶中,加入足量的3. 00mol-L'1的H2SO4,溶液和适量蒸馏水,用0.500molL-1的KMnO4溶液滴定,当MnO4-恰好完全被还原为 Mn2+时,消耗KMnO4溶液的体积为24.00 mL。
请回答下列问题:
(1)绿矾(FeSO47H2O)若保存不当或长期放置,易与空气中的氧气反应,该反应中 FeSO4表现的性质为_____(填字母)。
A.氧化性 B.还原性 C.氧化性和还原性 D.酸性
(2)用物质的量浓度为18.0 molL-1的浓硫酸配制100mL3.00 molL-1的H2SO4溶液时,量取浓硫酸需要的量筒规格为_____(填字母)。
A.10mL B.25mL C.50mL D.l00mL
(3)步骤2发生的离子反应如下,将该离子方程式配平:_____MnO4-+_____ C2O42-+_____H+=_____Mn2++_____CO2↑+_____H2O。
通过计算确定化合物A中x、y的值(请写出计算过程)。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象中不属于蛋白质变性的是
A. 打针时用酒精消毒 B. 用稀的福尔马林浸泡种子
C. 用波尔多液防治作物虫害 D. 蛋白质溶液加入食盐变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数为K1=5.0×10-2,K2=5.4×10-5;碳酸(H2CO3)的电离平衡常数为K1=4.5×10-7,K2=4.7×10-11。草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。回答下列问题:
(1)写出水溶液中草酸的电离方程式_____________________________________ 。
(2)相同条件下物质的量浓度都为0.1mol/L的Na2C2O4溶液的pH比Na2CO3溶液的pH______________ (填“大”、“小”或“相等”) 。
(3)常温下将0.4mol/L的KOH溶液20mL与0.2mol/L的草酸溶液20mL混合,则混合后溶液中阴离子浓度的大小顺序为_____________________________________ 。
(4)往Na2CO3溶液中加入少量草酸溶液,发生反应的离子方程式为________________。
(5)25℃时,向20mL碳酸钙的饱和溶液中逐滴加入c mol/L的草酸钾溶液20mL后,有草酸钙沉淀生成,则c的最小值为__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com