
科目:高中化学 来源: 题型:


| 元素 | M | F | |
| 电离能(kJ?mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
| 112 | ||||
6.02×1023×(
|
| 112 | ||||
6.02×1023×(
|
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 比任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 【化学--选修3物质结构与性质】
【化学--选修3物质结构与性质】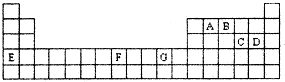
 该配离子中含有的化学键类型有
该配离子中含有的化学键类型有| 1 | 8 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省三明一中、二中高二上学期期末联考化学试卷(带解析) 题型:填空题
能源短缺是人类社会面临的重大问题,利用化学反应可实现多种形式的能量相互转化。请回答以下问题:
(1)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是旧键断裂和新键的形成过程。已知反应N2(g)+3H2(g) 2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据,计算a 的数值为_______kJ/mol。
2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据,计算a 的数值为_______kJ/mol。
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ·mol-1 | 436 | a | 945 |

查看答案和解析>>
科目:高中化学 来源:2012-2013学年陕西省宝鸡市高三第三次模拟理综化学试卷(解析版) 题型:填空题
下表是元素周期表的一部分,其中A—G分别代表一种元素。

请根据表中所列元素,回答下列问题:
(1)所列元素中第一电离能最小的是 (填元素符号);D元素原子核外有 种不同运动状态的电子;基态原子的价电子层中,未成对电子数最多的元素是 (填元素符号)。
(2)AC2分子的空间构型是 ,该分子中A原子的杂化方式为 。
(3)B的气态氢化物在水中的溶解度远大于A、C的气态氢化物的溶解度,原因是 。
(4)基态G2+的核外电子排布式是
,乙二胺(结构简式为H2N—CH2一CH2—NH2)分子中的碳原子的杂化方式为 ,G2+与乙二胺可形成配离子 该配离子中含有的化学键类型有 (填字母编号)。
该配离子中含有的化学键类型有 (填字母编号)。
a.配位键 b.极性键 c.离子键 d.非极性键
(5)化合物EF[F(AB)6]是一种常见的蓝笆晶体,其中的AB—与B2为等电子体,则、AB—的电子式为
。下图为该蓝色晶体晶胞的 (E+未画出),该蓝色晶体的一个晶胞中E+的个数为 个。
(E+未画出),该蓝色晶体的一个晶胞中E+的个数为 个。

查看答案和解析>>
科目:高中化学 来源:2014届福建省、二中高二上学期期末联考化学试卷(解析版) 题型:填空题
能源短缺是人类社会面临的重大问题,利用化学反应可实现多种形式的能量相互转化。请回答以下问题:
(1)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是旧键断裂和新键的形成过程。已知反应N2(g)+3H2(g) 2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据,计算a 的数值为_______kJ/mol。
2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据,计算a 的数值为_______kJ/mol。
|
化学键 |
H-H |
N-H |
N≡N |
|
键能/kJ·mol-1 |
436 |
a |
945 |
(2)甲醇是一种可再生能源,具有广泛的开发和应用前景。已知在常压下有如下变化:
① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =a kJ/mol
② H2O(g)=H2O(l) ΔH =b kJ/mol
写出液态甲醇完全燃烧生成二氧化碳和液态水的热化学方程式: 。
(3)可利用甲醇燃烧反应设计一个燃料电池。如下图1,用Pt作电极材料,用氢氧化钾溶液作电解质溶液,在两个电极上分别充入甲醇和氧气。
①写出燃料电池正极的电极反应式 。②若利用该燃料电池提供电源,与图1右边烧杯相连,在铁件表面镀铜,则铁件应是 极(填”A”或”B”);当铁件的质量增重6.4g时,燃料电池中消耗氧气的标准状况下体积为 L。

(4)如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图2装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾(电解槽内的阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)。
①该电解槽的阳极反应式为 ,单位时间内通过阴离子交换膜的离子数与通过阳离子交换膜的离子数的比值为 。
②从出口D导出的溶液是 (填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com