
| A. | 道尔顿-葡萄干面包模型 | B. | 卢瑟福-行星模型 | ||
| C. | 汤姆逊-电子轨道模型 | D. | 居里夫人-量子力学模型 |
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO3的物质的量为4.5mol的状态为平衡状态 | |
| B. | O2的平均反应速率为0.4amol•(L•min)-1 | |
| C. | SO2和O2的反应百分率相等 | |
| D. | 达到化学平衡状态时容器内压强减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
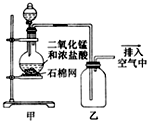
| A. | 该装置图中至少存在两处明显错误 | |
| B. | 烧瓶中的MnO2可换成KMnO4 | |
| C. | 在乙后连一盛有饱和食盐水的烧杯可进行尾气处理 | |
| D. | 在集气瓶的导管口处放一片湿润的淀粉碘化钾试纸可以证明是否有氯气逸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 当n=1时,X可能是C | B. | 当n=1时,X可能是Al | ||
| C. | 当n=2时,X可能是S | D. | 当n=2时,X可能是Na |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中四种粒子之间满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-) | |
| B. | 若溶液中粒子间满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+),则溶液中溶质为:NH3•H2O和NH4Cl | |
| C. | 若溶液中粒子间满足:c(Cl-)>c(NH4+)>c(H+)>c(OH-),则溶液中溶质只有NH4Cl | |
| D. | 若溶液中c(NH4+)=c(Cl-),则该溶液pH等于7. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(SO32-)=0.5 mol•L-1的溶液中:ClO-、Na+、Cl-、CO32- | |
| B. | pH=1的溶液中:NH4+、Na+、SO42-、Fe3+ | |
| C. | 强碱性溶液中:Na+、AlO2-、NO3-、HCO3- | |
| D. | 水电离产生的c(H+)=1×10-14mol•L-1的溶液中:HCO3-、NH4+、Cl-、Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙酸乙酯(乙酸):水 | |
| B. | 溴苯(溴):NaOH溶液 | |
| C. | 苯(苯酚):浓溴水 | |
| D. | 苯(甲苯):酸性高锰酸钾溶液、NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径由大到小的顺序为Z>X>Y | |
| B. | Z元素的氢化物是一种强酸 | |
| C. | 元素非金属性由强到弱的顺序为X>Y>Z | |
| D. | 3种元素的气态氢化物中,Y的气态氢化物还原性最强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com