
| A. | 硫原子结构示意图: | |
| B. | 氯化氢分子的电子式: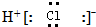 | |
| C. | 乙烯分子的结构式:CH2=CH2 | |
| D. | 硫酸铁的电离方程式:Fe2(SO4)3=2 Fe3++3SO42ˉ |
分析 A、硫原子的最外层有6个电子;
B、HCl为共价化合物;
C、乙烯的结构式中C-H不能省略;
D、硫酸铁为强电解质,完全电离,用等号;
解答 解:A、硫原子的最外层有6个电子,故原子结构示意图为 ,故A错误;
,故A错误;
B、HCl为共价化合物,故H和F原子间为共价键,故电子式为氯化氢分子中不存在氢离子和氯离子,氯化氢正确的电子式为: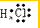 ,故B错误;
,故B错误;
C、乙烯的结构式中C-H不能省略,乙烯的结构式为: ,故C错误;
,故C错误;
D、硫酸铁为强电解质,完全电离,电离方程式:Fe2(SO4)3=2Fe3++3SO42-,故D正确.
故选D.
点评 本题考查了化学用语,注意结构式和结构简式的区别,书写结构简式时官能团不能省略,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
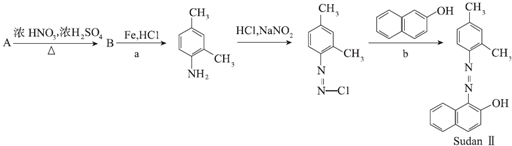
 .
. .②E→Fn
.②E→Fn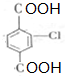 +nHOCH2CH2OH$→_{△}^{浓硫酸}$
+nHOCH2CH2OH$→_{△}^{浓硫酸}$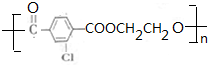 +2nH2O.
+2nH2O. 和另一种含氮有机分子G,G分子既能与氢氧化钠溶液反应,也能与盐酸反应.G分子中氮元素的质量分数为8.8%.
和另一种含氮有机分子G,G分子既能与氢氧化钠溶液反应,也能与盐酸反应.G分子中氮元素的质量分数为8.8%.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫酸亚铁铵[(NH4)2Fe(SO4)2•6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁.硫酸亚铁铵在 500℃时隔绝空气加热完全分解.回答下列问题:
硫酸亚铁铵[(NH4)2Fe(SO4)2•6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁.硫酸亚铁铵在 500℃时隔绝空气加热完全分解.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

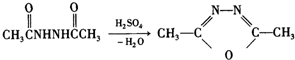
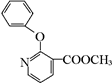 +H2N-NH2→
+H2N-NH2→ ,
, ,
,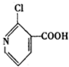 有多种同分异构体,其中符合下列条件的同分异构体共有4种.
有多种同分异构体,其中符合下列条件的同分异构体共有4种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的还原性:Y>X | |
| B. | 元素M与N只能形成一种化合物 | |
| C. | 元素Z的单质不能与元素N的氢化物反应 | |
| D. | 元素X、Y的最高氧化物对应的水化物可发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

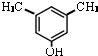 或
或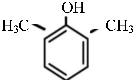 .
.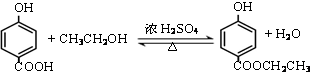 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
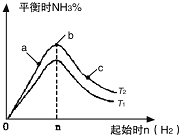 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸.
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com