

分析 (1)根据化合物中化合价的代数和为零分析;
(2)太阳能电池是把太阳能转化为电能;
(3)由流程图可知,还原沉淀硒时副产物为CaCl2,土金属氯化时要加入CaCl2;
(4)Cl2、CaCl2溶液作用生成次氯酸钙和HCl,根据原子守恒写出方程式;MeSe被次氯酸钙氧化得到亚硒酸、氯化钙及Me的氢氧化物;硝酸作氧化剂生成氮的氧化物会污染大气;
(5)FeCl2酸性溶液还原H2SeO4(强酸)为亚硒酸(弱酸)同时生成铁离子和水;SO2与H2SeO3反应生成Se和硫酸.
解答 解:(1)CaHAsO4中,Ca为+2价,H为+1价,O为-2价,由化合物中化合价的代数和为零可知,As的化合价为+(8-2-1)=+5;
故答案为:+5;
(2)太阳能电池能够向外提供电能,则是把太阳能转化为电能;
故答案为:太阳能转变为电能;
(3)由流程图可知,还原沉淀硒时副产物为CaCl2,含硒物料在用碱土金属氯化时要加入CaCl2,所以流程图中循环的物质是CaCl2溶液;
故答案为:CaCl2溶液;
(4)Cl2、CaCl2溶液作用生成次氯酸钙和HCl,反应的化学方程式为:CaCl2+2H2O+2Cl2=Ca(ClO)2+4HCl;MeSe被次氯酸钙氧化得到亚硒酸、氯化钙及Me的氢氧化物,其反应的化学方程式为为2MeSe+3Ca(ClO)2+4H2O=2H2SeO3+3CaCl2+2Me(OH)2;工业上也可用用硫酸与硝酸钠代替HCl、Cl2和CaCl2溶液,但是硝酸作氧化剂生成氮的氧化物属于有毒气体,会污染大气;
故答案为:CaCl2+2H2O+2Cl2=Ca(ClO)2+4HCl;2MeSe+3Ca(ClO)2+4H2O=2H2SeO3+3CaCl2+2Me(OH)2;生成氮的氧化物,污染较大;
(5)FeCl2酸性溶液还原H2SeO4(强酸)为亚硒酸(弱酸)同时生成铁离子和水,H2SeO4是强酸要写出离子形式,亚硒酸为弱酸要写成分子形式,则其反应的离子方程式为:4H++SeO42-+2Fe2+=H2SeO3+2Fe3++H2O;SO2与H2SeO3发生氧化还原反应,H2SeO3被还原为生成Se,二氧化硫被氧化为硫酸,其反应的离子方程式为:H2SeO3+2SO2+H2O=Se↓+4H++2SO42-;
故答案为:4H++SeO42-+2Fe2+=H2SeO3+2Fe3++H2O;H2SeO3+2SO2+H2O=Se↓+4H++2SO42-.
点评 本题考查了物质的制备方案设计、分离提纯,题目难度中等,侧重于物质性质应用的考查,考查学生的实验能力、分析问题和解决问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 我国许多城市已经推广使用清洁燃料以减少环境污染,如压缩天然气(CNG)、液化石油气(LPG),这两类燃料的主要成分均是烃类 | |
| B. | 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等 | |
| C. | 当今,实现煤的综合利用的主要途径是通过煤的干馏、煤气化和煤液化而获得洁净的燃料和多种化工原料 | |
| D. | 工业上利用金属活泼性不同,采用不同的冶炼方法冶炼金属,如电解法冶炼铝、热还原法冶炼铁、热分解法冶炼铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分馏石油时,温度计的水银球必须插入液面以下 | |
| B. | 制备乙酸乙酯时,加料顺序为浓硫酸、乙醇、乙酸 | |
| C. | 配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加,直至沉淀刚好溶解为止 | |
| D. | 实验室可用苯和溴水在Fe作催化剂的情况下制备溴苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
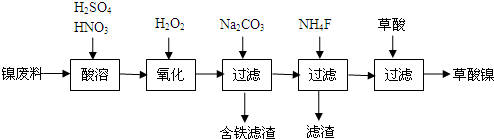
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器的总压强不随时间而变化 | |
| B. | 容器内气体的密度不再改变 | |
| C. | 单位时间内有nmolA2生成的同时有nmolB2消耗 | |
| D. | v正(A2)=2v逆(AB) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com