
| A. | H3O+和OH- | B. | CO和N2 | C. | NH3和F- | D. | CH4和NO |
分析 粒子中质子数等于原子的质子数之和,中性微粒中质子数=电子数,阳离子的电子数=质子数-电荷数,阴离子的电子数=质子数+电荷数.
解答 解:A.H3O+的质子数为11,电子数为11-1=10,OH-的质子数为9,电子数为9+1=10,电子数相同,故A错误;
B.CO的质子数为14,电子数为14,N2的质子数为14,电子数为14,电子数相同,故B错误;
C.NH3的质子数为7+1×3=10,电子数为10,F-的质子数为9,电子数为9+1=10,电子数相同,故C错误;
D.CH4的质子数为6+1×4=10,电子数为10,NO的质子数为7+8=15,电子数为15,电子数不同,故D正确;
故选D.
点评 本题主要考查微粒的质子数和电子数的关系,明确中性微粒、阳离子、阴离子的电子的数目计算是解答的关键,并注意中性微粒中质子数等于电子数.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,n(CO2):n(NH3)=1:1 | |
| B. | 达到化学平衡时,n(CO2):n(H20)=1:1 | |
| C. | 达到化学平衡时,n[CO(NH2)2]:n(H20)=1:1 | |
| D. | 达到化学平衡时,n(NH3):n(H20)=1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
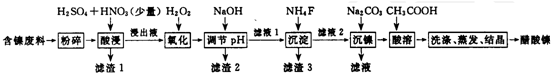
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH | 物质 | 20℃时溶解性(H2O) | |
| Fe3+ | 1.1 | 3.2 | CaS04 | 微溶 | |
| Fe2+ | 5.8 | 8.8 | NiF | 可溶 | |
| Al3+ | 3.0 | 5.0 | CaF2 | 难溶 | |
| Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.6×10-4 |
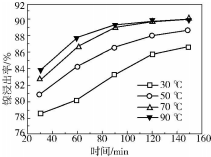
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | |
| B. | 在0.1 mol•L-1 NaHS溶液中:c(H+)=c(S2-)+c(OH-)+c(HS-) | |
| C. | 将0.1 mol•L-1 Na2CO3溶液和0.2 mol•L-1 NaHCO3溶液等体积混合:3c(Na+)=4c(CO32-)+4c(HCO3-) | |
| D. | 向0.1 mol•L-1 NaHSO4溶液中滴加氨水至溶液恰好呈中性:c(Na+)=c(NH4+)=c(SO42-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
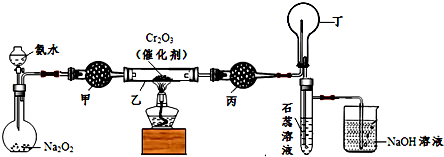
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
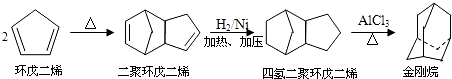
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2因导电能力强而用于制造通讯光缆 | |
| B. | 用秸秆中的纤维素直接水解制取燃料乙醇 | |
| C. | 处理废水时,加入明矾作为消毒剂除去水中的细菌 | |
| D. | 硅胶可作袋装食品的干燥剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com