
| A. | 乙烯与Cl2加成(1,2-二氯乙烷) | |
| B. | 乙烯与水加成(乙醇) | |
| C. | 氢气与苯催化剂加热的条件下发生的反应(环己烷) | |
| D. | 氯气与甲烷按照比例2:1在光照条件下反应(二氯甲烷) |
分析 A.乙烯含碳碳双键,与氯气加成产物只有一种;
B.乙烯含碳碳双键,与水发生加成反应只生成乙醇;
C.苯与氢气发生加成反应;
D.甲烷在光照下取代反应为链锁反应,产物复杂.
解答 解:A.乙烯含碳碳双键,与氯气加成产物只有一种,只生成1,2-二氯乙烷,为纯净物,故A不选;
B.乙烯含碳碳双键,与水发生加成反应只生成乙醇,乙醇为纯净物,故B不选;
C.苯与氢气发生加成反应生成环己烷,环己烷为纯净物,故C不选;
D.甲烷在光照下取代反应为链锁反应,产物复杂,生成多种卤代烃,产物为混合物,故D选;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意有机反应类型的判断,题目难度不大.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | Al2O3和NaOH溶液反应:Al2O3+2OH-═2AlO2-+H2↑ | |
| B. | AlCl3与过量NaOH溶液反应:Al3++3OH-═Al(OH)2↓ | |
| C. | NO2溶于水:3NO2+H2O═2NO3-+2H++NO↑ | |
| D. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 150℃时,向如图所示的容器(密封的隔板可自由滑动,整个过程中保持隔板上部压强不变)中加入4LN2和H2的混合气体,在催化剂作用下充分反应(催化剂体积忽略不计),反应后恢复到原温度.平衡后容器体积变为3.4L,容器内气体对相同条件的氢气的相对密度为5.
150℃时,向如图所示的容器(密封的隔板可自由滑动,整个过程中保持隔板上部压强不变)中加入4LN2和H2的混合气体,在催化剂作用下充分反应(催化剂体积忽略不计),反应后恢复到原温度.平衡后容器体积变为3.4L,容器内气体对相同条件的氢气的相对密度为5.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
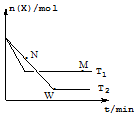 一定温度下,向某密闭容器中通入X,发生反应:4X(g)?2Y(g)+Z(g)△H,在温度分别为T1、T2 的条件下X的物质的量n(X) 随时间t的变化曲线如图所示.下列有关叙述错误的是( )
一定温度下,向某密闭容器中通入X,发生反应:4X(g)?2Y(g)+Z(g)△H,在温度分别为T1、T2 的条件下X的物质的量n(X) 随时间t的变化曲线如图所示.下列有关叙述错误的是( )| A. | △H<0 | |
| B. | 平衡时Z的产率:T2<T1 | |
| C. | M、N、W三点对应的混合气体的平均相对分子质量:W>M>N | |
| D. | M点的正反应速率大于N点的逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ①②④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 min内,用A表示的反应速率是0.4 mol•L-1•min-1 | |
| B. | 分别用B、C、D表示的反应速率其比值是1:1:1 | |
| C. | 2 min时间内反应速率,用B表示是0.3 mol•L-1•min-1 | |
| D. | 2 min内用C表示的反应速率v (C)是0.3 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 操作及现象 |
| i | 取少量固体样品,加入过量稀盐酸,固体溶解,产生无色气体(经检验为H2),溶液呈浅黄色 |
| ii | 向i所得溶液中加入少量KSCN溶液,溶液呈浅红色,再加入H2O2溶液,产生无色气体(经检验为O2),溶液变为深红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
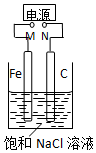
| A. | M接电源正极,N接电源负极,将C电极换成Cu电极,电解质溶液换成CuSO4溶液,则可实现在铁上镀铜 | |
| B. | M接负极,N接正极,在溶液中滴人酚酞试液,C电极周围溶液变红 | |
| C. | M接负极,N接正极,若把烧杯中溶液换成1 L CuSO4溶液,反应一段时间后,烧杯中产生蓝色沉淀 | |
| D. | M接负极,N接正极,当两极产生气体总量为22.4 L(标准状况)时,生成1molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com