
| A. | 12.8 g | B. | 19.2 g | C. | 32.0 g | D. | 38.4 g |
分析 反应的离子方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,要使溶解铜的质量最大,则氢离子和硝酸根浓度满足化学计量数即4:1,硝酸全部起氧化剂作用,设硫酸浓度为x,则硝酸浓度为:2.5mol/L-x,溶液中氢离子浓度共:2x+(2.5mol/L-x),则$\frac{2x+(2.5mol/L-x)}{.5mol/L-x}$=4:1,解得x=1.5mol/L,硝酸浓度为1mol/L,根据方程式可计算溶解铜的质量.
解答 解:反应的离子方程式为:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,要使溶解铜的质量最大,则氢离子和硝酸根浓度满足化学计量数4:1,硝酸全部起氧化剂作用,
设硫酸浓度为x,则硝酸浓度为:2.5mol/L-x,溶液中氢离子浓度共:2x+(2.5mol/L-x),
则$\frac{2x+(2.5mol/L-x)}{.5mol/L-x}$=4:1,
解得:x=1.5mol/L,
则硝酸浓度为:2.5mol/L-x=1mol/L,硝酸得物质的量为:0.2L×1mol/L=0.2mol,
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3×64g 2mol
m 0.2mol
则能溶解铜的最大质量为:m=$\frac{3×64g×0.2mol}{2mol}$=19.2g,
故选B.
点评 本题考查物质的量的计算、化学方程式的计算,题目难度中等,根据反应原理得出“氢离子和硝酸根浓度满足化学计量数4:1”为解答关键,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | NaCl的电子式: | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | CO2的分子模型示意图: | D. | O2-的离子结构示意图: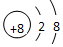 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硫化亚铁中加入稀硫酸 2H++S2-→H2S↑ | |
| B. | 向苯酚钠溶液中通入少量的CO2 -O-+CO2+H2O→ -O-+CO2+H2O→ -OH+HCO3- -OH+HCO3- | |
| C. | 向碳酸氢钠溶液中滴入少量石灰水 HCO3-+Ca2++OH-→CaCO3↓+H2O | |
| D. | 向明矾溶液中加入过量的氨水 A13++3NH3•H2O→Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
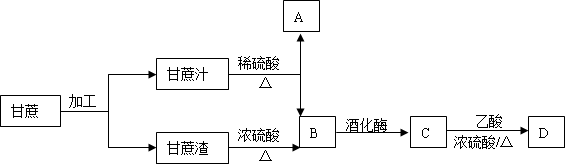
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 | |
| B. | 若物质的量浓度相同的NH4Cl和NH3•H2O混合溶液pH>7,则在pH=7的NH4Cl和NH3•H2O混合溶液中:c(NH4+)>c(NH3•H2O) | |
| C. | 0.1mol•L-1的NaHSO3溶液:c(H+)-c(OH-)=c(SO32-)-2c(H2SO3) | |
| D. | 0.1mol/LNa2CO3溶液和0.1mol/LNaHSO4溶液等体积混合,溶液中c(Na+)+c(H+)=c(CO32-)+c(SO42-)+c(HCO3-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
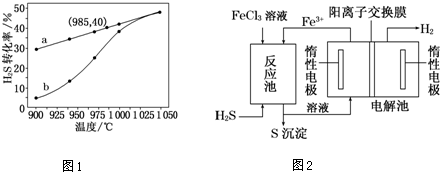
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散系的分类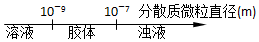 | |
| B. | Fe与Cl2反应的产物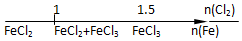 | |
| C. | 向AlCl3溶液滴加NaOH溶液后铝的存在形式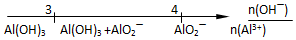 | |
| D. | Na与O2反应的产物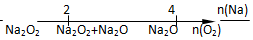 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com