
【题目】为测定某硫酸铜样品中硫酸铜的含量(杂质不溶于水,不含铜元素,不与其他物质发生反应),进行了如图实验:

(1)上述实验过程中发生反应的化学方程式为______。
(2)根据已知条件列出求解C烧杯中参加反应的硫酸铜质量(X)的比例式___。
(3)配制上述实验所用的氢氧化钾溶液,需要质量分数为40%的氢氧化钾溶液的质量为___。
(4)样品中硫酸铜的质量分数为___。
(5)D烧杯溶液中溶质的质量分数为____。
(6)若用湿法冶金的方法冶炼出100kg含杂质4%的铜,需要这种硫酸铜的质量为多少?(写出计算过程)____
【答案】2KOH+CuSO4=Cu(OH)2↓+K2SO4 ![]() =
=![]() 56g 80% 8.7% 300kg
56g 80% 8.7% 300kg
【解析】
(1)氢氧化钾和硫酸铜反应生成硫酸钾和氢氧化铜,反应方程式为:2KOH+CuSO4=Cu(OH)2↓+K2SO4。
(2)设C烧杯中参加反应的硫酸铜质量为x,参加反应的氢氧化钾的质量为y,生成硫酸钾的质量为z,由于对应生成的氢氧化铜的质量为4.9g,则:
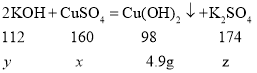
![]() ,
,![]() 。
。
![]() ,
,![]() ,
,![]() 。
。
(3)因为上述实验添加了两次氢氧化钾溶液,故需要质量分数为![]() 的氢氧化钾溶液的质量为:
的氢氧化钾溶液的质量为:![]() 。
。
(4)第二次加入氢氧化钾生成![]() 的氢氧化铜沉淀,所以第一次也生成了
的氢氧化铜沉淀,所以第一次也生成了![]() 的沉淀,样品中不溶性杂质的质量是
的沉淀,样品中不溶性杂质的质量是![]() ,所以样品中硫酸铜的质量分数为:
,所以样品中硫酸铜的质量分数为:![]() 。
。
(5)由(2)得C烧杯中反应生成硫酸钾的质量为8.7g,由实验示意图可知,B烧杯中生成硫酸钾的质量也为![]() ,故D烧杯溶液中溶质的质量分数为:
,故D烧杯溶液中溶质的质量分数为:![]() 。
。
(6)需要这种硫酸铜的质量为a。
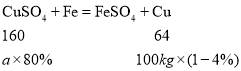
![]() ,解得
,解得![]() 。
。


科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容容器中,当下列物理量不再发生变化时,能说明下列反应:C(s)+CO2(g) ![]() 2CO(g)达到平衡状态的是:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的浓度之比等于化学计量数之比,⑦某种气体的百分含量
2CO(g)达到平衡状态的是:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的浓度之比等于化学计量数之比,⑦某种气体的百分含量
A. ①③④⑤⑦ B. ①②③④⑦
C. ②③④⑥⑦ D. ①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某活动小组利用如图实验装置制取氧气并进行探究活动。

(1)写出标号仪器的名称:①_____,②____。
(2)用装置A制取氧气的化学方程式是____。若用装置A、B、C来制取一瓶干燥的氧气,装置B中应盛放的是___,导管口的连接顺序是_____。
(3)集气瓶内收集到的气体中氧气的体积分数是多少呢?
[实验验证]活动小组设计了以下两套实验装置,用来测定该瓶气体中氧气的体积分数。在氮气环境下,将过量的铜粉分别装入干燥的硬质玻璃管和具支试管后,密封。用两支干燥的注射器从该瓶中抽取气体,分别按图M1-6连接,推拉注射器一段时间后,用酒精灯在铜粉部位加热,加热时反复推拉注射器至反应完全。

①甲装置比乙装置更合理,理由是_______。
②用甲装置测定氧气的体积分数,需要测定的实验数据是_____。
[反思交流]实验完毕,待装置冷却至室温后,应先将气球内的气体全部挤出,再读数,否则会使测得的实验结果______ (填“偏大”偏小”或“无影响”),原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:
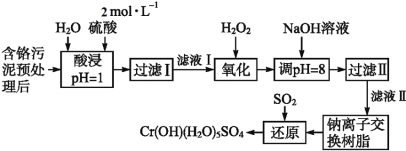
已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1)实验室用18.4 mol·L-1的浓硫酸配制480 mL 2 mol·L-1的硫酸,需量取浓硫酸_________mL;配制时所用玻璃仪器除量筒、胶头滴管、烧杯和玻璃棒外,还需__________________________。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:__________。
(3)加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2O72-转化为CrO42-,写出该反应的离子方程式__________________。
(4)钠离子交换树脂的反应原理为:Mn+ + n NaR = MRn + n Na+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有__________________。
(5)写出上述流程中用SO2进行还原时发生反应的离子方程式:_________________。
(6)沉淀滴定法是测定粒子浓度的方法之一,为了测定某废水中SCN-浓度,可用标准AgNO3溶液滴定待测液,已知:
银盐性质 | AgCl | AgI | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 黄 | 白 | 砖红 | 白 |
Ksp | 1.8×10-10 | 8.3×10-17 | 1.2×10-16 | 3.5×10-11 | 1.0×10-12 |
滴定时可选为滴定指示剂的是_________(选填编号),滴定终点现象是:________。
A.NaCl B.K2CrO4 C.KI D.NaCN
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制1mol/L的NaOH溶液240mL,
(1)实验操作中用天平称量___gNaOH固体;
(2)容量瓶在使用前的操作是___
(3)若实验时遇到下列情况,所配溶液的浓度偏大的是___。
①称量氢氧化钠固体的时间过长。 ②容量瓶用蒸馏水洗涤后残留有少量的水。
③溶液未冷却即转入容量瓶。 ④在转移氢氧化钠溶液后未洗涤烧杯。
⑤定容时俯视刻度线。⑥摇匀后,发现溶液的液面低于刻度线,又加水至刻度线。
(4)取配制的1mol/L的NaOH溶液10mL,再稀释成100mL,再从中取出10mL,这10mL溶液的物质的量浓度为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~F为初中化学常见的六种物质,且都含有一种相同元素,它们相互间的关系如图所示。已知A、B、C、D、E是不同类别的物质,C俗称纯碱,F是人体中含量最多的物质。(部分反应物、生成物及反应条件己略去)

请回答:
(1)写出B、D、F的化学式:B____,D____,F_____。
(2)写出B物质的一种用途_____,C与E反应的化学方程式是_________。
(3)图中物质相互间发生的反应。未涉及的基本反应类型是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界能源消费的90%以上依靠化学技术。回答下列问题:
(1)质子交换膜燃料电池中作为燃料的H2通常来自水煤气。
已知:C(s)+![]() O2(g)=CO(g) △H1=-110.35kJ·mol-1
O2(g)=CO(g) △H1=-110.35kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
H2O(1)=H2O(g) △H3=+44.0kJ·mol-1
则反应C(s)+H2O(g)![]() CO(g)+H2(g) △H4=___________。
CO(g)+H2(g) △H4=___________。
某实验小组在实验室模拟反应C(s)+H2O(g)![]() CO(g)+H2(g),其平衡常数表达式为K=___________。一定温度下,在2L盛有足量炭粉的恒容密闭容器中通入0.8molH2O,6min时生成0.7gH2。则6min内以CO表示的平均反应速率为___________(保留3位有效数字)。
CO(g)+H2(g),其平衡常数表达式为K=___________。一定温度下,在2L盛有足量炭粉的恒容密闭容器中通入0.8molH2O,6min时生成0.7gH2。则6min内以CO表示的平均反应速率为___________(保留3位有效数字)。
(2)燃料气(主要含N2和H2,还含有少量其他杂质)中的CO会使电极催化剂中毒,使用CuO/CeO2催化剂可使CO优先氧化而脱除。CeO2可由草酸铈[Ce(C2O4)3]灼烧制得,反应的化学方程式为___________。在CuO/CeO2催化剂中加入不同的酸(HIO3或H3PO4),测得燃料气中CO优先氧化的转化率随温度的变化如下图所示。
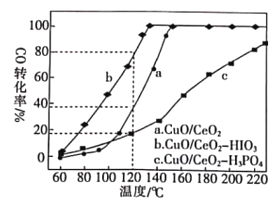
加入H3PO4___________(填“促进”或“抑制”)CuO/CeO2的催化。温度为120℃,催化剂为CuO/CeO2-HIO3时,若燃料气流速为1800mL·min-1,CO的体积分数为0.68%,则反应0.5h后CO的体积为___mL。
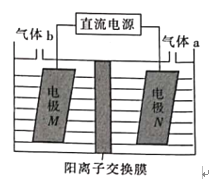
(3)LiOH是制备锂离子电池正极材料的重要原料,利用LiCl溶液电解制备得LiOH的装置如下图,LiOH在___________(填“M极”或“N极”)制得,N极产生的气体a通入淀粉KI溶液溶液变蓝,持续一段时间后,蓝色可逐渐褪去。据此写出N极的电极反应式:__________,蓝色逐渐褪去是因为溶液中逐渐生成HIO3,写出此反应的化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,浓度均为 0.10 mol/L,体积均为 V0 的 MOH 和ROH 溶液,分别加水稀释至体积 V,pH 随![]() 的变化如图所示。下列叙述正确的是
的变化如图所示。下列叙述正确的是

A. 稀释前两溶液的 Ka : MOH 溶液>ROH 溶液
B. ROH 的电离程度:b 点小于 a 点
C. 两溶液在稀释过程中,c(H+)均逐渐减少
D. 当![]() 时,若两溶液同时升高温度,则c(R+)/c(M+)增大
时,若两溶液同时升高温度,则c(R+)/c(M+)增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com