
| A. | H2SO4=H2++SO42- | B. | Ba(OH)2=Ba2++OH- | ||
| C. | KClO3=K++ClO3- | D. | MgSO4═Mg+2+SO42- |
分析 电离方程式遵循原子个数守恒、电荷守恒规律,注意离子符号书写;
A.硫酸为强酸,是强电解质,完全电离;
B.氢氧化钡强碱,是强电解质,完全电离;
C.氯酸钾为盐,是强电解质,完全电离;
D.硫酸镁盐,属于强电解质,完全电离.
解答 解:A.硫酸为强酸,是强电解质,完全电离,电离方程式:H2SO4=2H++SO42-,氢离子书写错误,故A错误;
B.氢氧化钡强碱,是强电解质,完全电离,电离方程式:Ba(OH)2=Ba2++OH-,故B正确;
C.氯酸钾为盐,是强电解质,完全电离,电离方程式:KClO3=K++ClO3-,故C正确;
D.硫酸镁盐,属于强电解质,完全电离,电离方程式:MgSO4═Mg+2+SO42-,故D正确;
故选:A.
点评 本题考查了电解质电离方程式的书写,准确判断电解质的强弱,明确电离方式是解题关键,题目难度不大.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:选择题
| A. | 很多城市对废旧电池进行回收处理 | |
| B. | 有些国家对聚乙烯等塑料垃圾进行了深埋或者倾倒入大海处理 | |
| C. | 不少地区正在使用沼气,太阳能,风能等能源替代传统的煤炭 | |
| D. | 许多地方政府出台相关法规来保护生物物种多样性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
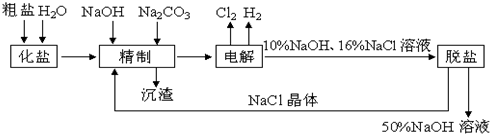
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
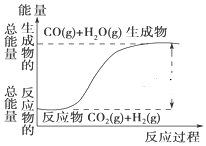
| A. | 其热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=41kJ•mol-1 | |
| B. | 该反应为吸热反应 | |
| C. | 该反应为放热反应 | |
| D. | 当H2O为液态时,其反应热值大于41kJ•mol-1. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分解反应均为吸热反应 | |
| B. | lmol 酸与lmol 碱恰好中和时所放出的热量叫中和热 | |
| C. | 若S ( s )+O2 (g)=SO2(g)△H1,S(g)+O2(g)=SO2(g)△H2;△H1>△H2 | |
| D. | 已知2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
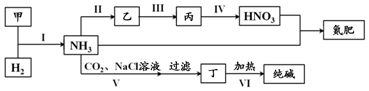
| A. | 甲、乙、丙三种物质中都含有氮元素 | |
| B. | 反应II、III和Ⅳ的氧化剂相同 | |
| C. | VI的产物可在上述流程中被再次利用 | |
| D. | V中发生反应:NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去铁粉中混有少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤 | |
| B. | 光照氯水有气泡冒出,该气体主要为Cl2 | |
| C. | 制备Fe(OH)3胶体,通常是将Fe(OH)3固体溶于热水中 | |
| D. | Na[Al(OH)4]溶液和盐酸可以通过相互滴加的方法来鉴别,NaHCO3溶液和Ca(OH)2溶液也可以通过相互滴加的方法来鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知CaO+H2O═Ca(OH)2放出大量的热,故可把该反应设计成原电池 | |
| B. | 因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中,若能组成原电池,必是铁做负极、铜做正极 | |
| C. | 理论上说,任何能自发进行的氧化还原反应都可设计成原电池 | |
| D. | 某原电池反应为Cu+2AgNO3═Cu(NO3)2+2Ag,装置中的盐桥内可以是含琼脂的KCl饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、NO3-、MnO4- | B. | K+、Na+、Cl-、SO42- | ||
| C. | K+、Na+、Br-、Cu2+ | D. | Na+、Ba2+、OH-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com