
| 运用化学反应原理可以更好的分析化学反应的本质 。 (1)下列四组物质反应,其中与其它三组有本质不同的是_______。 A.Na2O2 + H2O B.F2 + H2O C.Cl2 + H2O D.NO2 + H2O (2)在 25℃下,向浓度均为 0.1mol·L-1 的NaCl和KBr混合溶液中逐滴加入硝酸银溶液,先生成_______沉淀 ( 填化学式 );当两种沉淀共存时溶液中 (3) 汽车尾气净化中的一个反应如下:2NO(g)+2CO(g)  N2(g)+2CO2(g) 该反应混合体系中NO 的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题: N2(g)+2CO2(g) 该反应混合体系中NO 的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题: | ||||||||
 | ||||||||
① 2NO(g)+2CO(g) N2(g)+2CO2(g) 的△H _____0( 填 “>” 或 “<”) N2(g)+2CO2(g) 的△H _____0( 填 “>” 或 “<”) ②若温度为Tl 、T2, 反应的平衡常数分别为 Kl、K2, 则K1_____K2;若反应进行到状态D 时,V正___V逆(填“>”、“<”或“=”) ③在恒容的密闭容器中,该反应达平衡后,改变某一条件,下列示意图不正确的是 | ||||||||
 | ||||||||
| (4)分析下表提供的数据: | ||||||||
| ||||||||
| ① 84 消毒液 ( 有效成分为 NaClO) 久置于空气中会失效,写出发生反应的离子方程式:____________; __________________。 ②判断在等浓度的 NaClO、NaHCO3混合溶液中,各种离子浓度由大到小的顺序:_________________。 |
科目:高中化学 来源: 题型:阅读理解
| t/s | 0 | 500 | 1000 |
| C(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
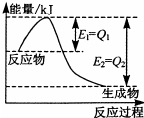 运用化学反应原理研究氮、硫、氯等单质及其化合物的反应有重要的意义.
运用化学反应原理研究氮、硫、氯等单质及其化合物的反应有重要的意义.查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
![]() (1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下,向平衡体系中通入氩气,平衡 移动(填“向左”“向右”或“不”);使用催化剂后反应的△H(填“增大”“减小”或“不改变”) 。
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下,向平衡体系中通入氩气,平衡 移动(填“向左”“向右”或“不”);使用催化剂后反应的△H(填“增大”“减小”或“不改变”) 。
(2)一定温度下,在恒容密闭容器中N2O5可发生化学反应:
![]() 2 N2O5(g) 4NO2(g)+O2(g) △H>0
2 N2O5(g) 4NO2(g)+O2(g) △H>0
①下表为反应T1温度下的部分实验数据:
| t/s | 0 | 500 | 1000 |
| C(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.48 |
则500s内N2O5的分解速率为 。
②在T2温度下,反应1000s时测得NO2的浓度为4.98 mol·L-1,则T2 T1(填
“>”“<”“=”)
(3)已知肼分子(H2N—NH2)可以在氧气中燃烧生成氮气和水。
①利用肼、氧气与KOH溶液组成碱性燃料电池,请写出电池负极的电极反应式
②用电离方程式表示肼的水溶液呈碱性的原因
③肼是强还原剂,与氧化剂反应时放出大量的热,如:N2H4(1)+2H2O2(1)==N2(g)+4H2O(g) △H= —642.2kJ·mol-1
因此肼可以作为火箭推进剂。根据上述信息,你认为是否可以通过改变反应条件,由氮气和水蒸气来制取肼 。说明原因 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com