
五种短周期元素的某些性质如下表所示:
| 元素代号 | X | W | Y | Z | Q |
| 原子半径(×10-12 m) | 37 | 99 | 66 | 104 | 154 |
| 主要化合价 | +1 | -1、+7 | -2 | -2、+6 | +1 |
下列说法正确的是( )
A.由Q与Y形成的化合物中只存在离子键
B.Z与X之间形成的化合物具有还原性
C.X、Y元素组成的化合物的沸点高于X、Z元素组成化合物的沸点是由于Y非金属性比Z强
D.Y、Q、W三种元素组成化合物的水溶液一定显碱性
科目:高中化学 来源: 题型:
(1)某酯的分子式为C6H12O2,其变化如图所示:
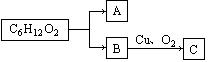
若A能发生银镜反应,C不能发生银镜反应,则该酯的可能结构有 种。
(2)将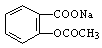 转变为
转变为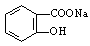 的流程为
的流程为
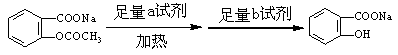
则a试剂是 ,b试剂是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。
请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为 ,第一电离能最小的元素是 (填元素符号)。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是
(填化学式),呈现如此递变规律的原因是 。
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为 、
另一种的晶胞如图二所示,该晶胞的空间利用率为 ,若此晶胞中的棱长为356.6
pm,则此晶胞的密度为  (保留两位有效数字)。(
(保留两位有效数字)。(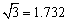 )
)

(4)D元素形成的单质,其晶体的堆积模型为 ,D的醋酸盐晶体局部结构
如图三,该晶体中含有的化学键是 (填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是 。请写出
上述过程的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
为了证明硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]晶体的成分中含有NH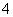 、Fe2+、SO
、Fe2+、SO
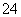 和H2O,下列实验叙述中不正确的是
和H2O,下列实验叙述中不正确的是
A.取少量硫酸亚铁铵晶体放入试管中,加热,试管口有液体生成 ,则可证明晶体的成分中含有结晶水
,则可证明晶体的成分中含有结晶水
B.取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液 ,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH
,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH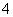
C.取适量硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO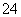

D.取适量硫酸亚铁铵晶体溶于水,得浅绿色溶液,滴入2滴KSCN溶液,溶液不显血红色,再滴入几滴新制氯水,溶液变为血红色,则可证明晶体的成分中含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
氢能的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等。
(1) Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①Ti2+基态的电子排布式可表示为________。
 ②BH
②BH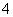 的空间构型是________(用文字描述)。
的空间构型是________(用文字描述)。
(2) 液氨是富氢物质,是氢能的理想载 体,利用N2+3H2
体,利用N2+3H2
 2NH3实现储氢和输氢。下列说法正确的是________(多项选择)。
2NH3实现储氢和输氢。下列说法正确的是________(多项选择)。
A. NH3分子中N原子采用sp3杂化
B. 相同压强时,NH3沸点比PH3高
C.[Cu (NH3)4]2+离子中,N原子是配位原子
D.CN-的电子式为[:C┇┇N:]-
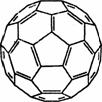 (3) 2008年,Yoon等人发现Ca与C60(分子结构如下图左)生成的Ca32C60能
(3) 2008年,Yoon等人发现Ca与C60(分子结构如下图左)生成的Ca32C60能 大量吸附H2分子。
大量吸附H2分子。

①C60晶体 易溶于苯、CS2,C60是________分子(填“极性”或“非极性”)。
易溶于苯、CS2,C60是________分子(填“极性”或“非极性”)。
②1 mol C60分子中,含有σ键数目为________。
(4) MgH2是金属氢化物储氢材料,其晶胞结构如上图右所示,已知该晶体的密度为a g·cm-3,则晶胞的体积为________cm3[a、NA表示(NA表示阿伏加德罗常数的值)]。
查看答案和解析>>
科目:高中化学 来源: 题型:
人体血液里Ca2+离子的浓度一般采用mg/mL来表示。加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定,使草酸转化成CO2逸出。试回答:
(1)现需要80 mL 0.02 mol·L-1标准KMnO4溶液来进行滴定,则配制溶液时需要的玻璃仪器有烧杯、玻璃棒和______________________;配制时, KMnO4溶液应用强酸酸化,本实验选择________作酸化剂。若选择HNO3酸化,则结果可能________(填“偏大”“偏小”或“不变”)。
(2)草酸与酸性KMnO4溶液反应的离子方程式为_______________________________。
(3)滴定时,根据现象_______________________________________,即可确定反应达到终点。
(4)滴定的实验数据如下所示:
| 实验编号 | 待测血液的体积/mL | 滴入KMnO4溶液的体积/mL |
| 1 | 20.00 | 11.95 |
| 2 | 20.00 | 13.00 |
| 3 | 20.00 | 12.05 |
经过计算,血液样品中Ca2+离子的浓度为________mg/mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列类比关系正确的是
A.AlCl3与过量NaOH溶液反应生成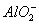 ,则与过量NH3·H2O也生成
,则与过量NH3·H2O也生成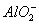
B.Na 2O2与CO2反应生成Na2CO3和O2,则与SO2反应可生成Na2SO3和O2
2O2与CO2反应生成Na2CO3和O2,则与SO2反应可生成Na2SO3和O2
C.Fe与Cl2反应生成FeCl3,则与I2反应可生成FeI3
D.Al与Fe2O3能发生铝热反应,则与MnO2也能发生铝热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
钠的化合物是中学化学常见物质,结合你掌握的化学知识,下列说法合理的是
A.锌粒与盐酸反应时,若加入适量氯化钠晶体,可明显加快反应速率
B.氯化钠中所含化学键为离子键,含离子键的化合物一定是离子化合物
C.Na2O2能与水反应,所以Na2O2可以作气体的干燥剂
D.氯化钠溶液导电是化学变化,而熔融态氯化钠导电是物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
硝基苯甲酸乙酯在OH-存在 下发生水解反应:
下发生水解反应:
O2NC6H4COOC2H5+OH- O2NC6H4COO-+C2H5OH
O2NC6H4COO-+C2H5OH
两种反 应物的初始浓度均为0.050 mol·L-1,15 ℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。回答下列问题:
应物的初始浓度均为0.050 mol·L-1,15 ℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。回答下列问题:
| t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
| α/% | 0 | 33.0 | 41.8 | 48.8 | 58.0 | 69.0 | 70.4 | 71.0 | 71.0 |
(1)列式计算该反应在120~180 s与180~240 s 区间的平均反应速率________、________;比较两者大小可得出的结论是____________________。
(2)列式计算15 ℃时该反应的平衡常数________。
(3)为提高O2NC6H4COOC2H5的平衡转化率,除可适当控制反应温度外,还可采取的措施有________(要求写出两条)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com