
【题目】2019年为国际化学元素周期表年。鉝(Lv)是116号主族元素。下列说法不正确的是( )
A.Lv位于第七周期第ⅥA族B.Lv在同主族元素中金属性最弱
C.Lv的同位素原子具有相同的电子数D.中子数为177的Lv核素符号为![]() Lv
Lv
 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:
【题目】常温下,体积相同、浓度均为1.0 mol·L–1的HX溶液、HY溶液,分别加水稀释,稀释后溶液的pH随稀释倍数的对数的变化如图所示,下列叙述正确的是( )
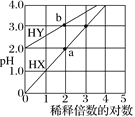
A.HX是强酸,溶液每稀释10倍,pH始终增大1
B.常温下HY的电离常数约为1.0×10–4
C.溶液中水的电离程度:a点大于b点
D.消耗同浓度的NaOH溶液体积:a点大于b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有体积相同的四种溶液:①pH=3的CH3COOH溶液;②pH=3的盐酸;③pH=11的氨水;④pH=11的NaOH溶液。下列说法正确的是
A.①和②混合溶液中:c(H+)=3.0 mol·L-1
B.①和④混合溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH)
C.②和③混合溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-)
D.四种溶液稀释100倍,溶液的pH:③>④>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】β硝基苯乙烯是一种黄色针状晶体,熔点55~58 ℃,沸点250~260 ℃,不溶于水,易溶于乙酸、二氯甲烷等有机溶剂。制备原理如下:
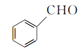 +CH3NO2
+CH3NO2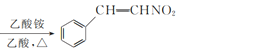
(1) 反应装置冷凝管中水应从________(填“a”或“b”)处通入。
(2)制备过程中,需在搅拌下滴加苯甲醛,控制滴加速率反应6 h,加热温度在110 ℃左右,那么采用的加热方法为________,如温度过高时,则可以采取________措施。
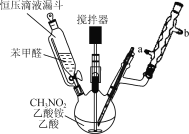
(3)反应混合液需加入一定量的水才析出黄色絮状物,加水的作用是________。
(4)过滤后用95%乙醇重结晶,再进行抽滤可获得黄色棱形晶体。抽滤装置所包含的仪器除减压系统外还有布氏漏斗和________(填仪器名称)。
(5)实验中使用恒压滴液漏斗的优点是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中的许多植物中含有醛,其中有些具有特殊香味,可作为植物香料使用,例如桂皮含肉桂醛(![]() CH=CH-CHO),杏仁含苯甲醛(
CH=CH-CHO),杏仁含苯甲醛(![]() CHO)。下列说法错误的是
CHO)。下列说法错误的是
A. 肉桂醛,苯甲醛都能发生加成反应、取代反应和聚合反应
B. 可用新制氢氧化铜悬浊液检验肉桂醛分子中的含氧官能团
C. 肉桂醛和苯甲醛互为同系物
D. 苯甲醛分子中所有原子可能位于同一平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.3g乙醇和一定量的氧气混合点燃,恰好完全燃烧,放出热量为68.35kJ。
(1)该反应的热化学方程式为___。
(2)已知:
化学键 | Si-Cl | H-H | H-Cl | Si-Si |
键能/kJ·mol-1 | 360 | 436 | 431 | 176 |
且硅晶体中每个硅原子和其他4个硅原子形成4个共价键。
工业上所用的高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),该反应的反应热为___kJ·mol-1。
Si(s)+4HCl(g),该反应的反应热为___kJ·mol-1。
(3)已知水的比热容为4.2×10-3kJ·g-1·℃-1。8g硫黄在O2中完全燃烧生成气态SO2,放出的热量能使500g H2O的温度由18℃升至58℃,则硫黄燃烧热的热化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家格哈德·埃特尔。他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论。在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示。下列说法错误的是

A.汽车尾气的主要污染成分包括CO和NO
B.NO2是该过程的中间产物
C.NO和O2必须在催化剂表面才能反应
D.该催化转化的总反应方程式为:2NO+O2+4CO![]() 4CO2+N2
4CO2+N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3O4中含有![]() 、
、![]() ,分别表示为Fe(Ⅱ)、Fe(Ⅲ),以Fe3O4/Pd为催化材料,可实现用H2消除酸性废水中的致癌物NO2-,其反应过程示意图如图所示,下列说法不正确的是
,分别表示为Fe(Ⅱ)、Fe(Ⅲ),以Fe3O4/Pd为催化材料,可实现用H2消除酸性废水中的致癌物NO2-,其反应过程示意图如图所示,下列说法不正确的是

A. Pd上发生的电极反应为:H2 - 2e- 2H+
B. Fe(Ⅱ)与Fe(Ⅲ)的相互转化起到了传递电子的作用
C. 反应过程中NO2-被Fe(Ⅱ)还原为N2
D. 用该法处理后水体的pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图

请回答下列问题(用元素符号表达):
(1) X、Y、Z 三种元素的原子半径大小顺序是____________
(2)X 与 Y 形成化合物Y2X2,写出该化合物的电子式____________
(3)RX2是一种强氧化性气体,可用于污水处理,能将 CN-氧化,生成两种无毒气体,该反应离子方程式为 ____________
(4)某阴离子 Wa2-(a 为2 6之间的数字)在碱性溶液中被 BrO3离子氧化为 WO42-,而BrO3-离子被还原为Br-,反应中消耗的 BrO3-离子和 OH离子的物质的量之比为 2:3,则 a =____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com