
��ͼΪʵ����ijŨ�����Լ�ƿ��ǩ�ϵ��й����ݣ��Ը��ݱ�ǩ�ϵ��й����ݣ��ش��������⣺
��1����Ũ������HCl�����ʵ���Ũ��Ϊ
��
��2��ȡ����������ĸ�������Һʱ�������������в�����ȡ����Ķ��ٶ��仯����
��
A����Һ��HCl�����ʵ���
B����Һ��Ũ��
C����Һ��Cl
-����Ŀ
D����Һ���ܶ�
��3��ijѧ����������Ũ���������ˮ����500mL���ʵ���Ũ��Ϊ0.400mol?L
-1��ϡ���ᣮ
�ɹ�ѡ�õ������У��ٽ�ͷ�ιܣ��ڲ����������ձ�����ҩ�ף�����Ͳ����������ƽ��
��ش��������⣺
������ϡ����ʱ����ȱ�ٵ�������
��д�������ƣ����������ϱ������������е�
��
A���¶� B��Ũ�� C������ D��ѹǿ E���̶���
�ڸ�ѧ����Ҫ��ȡ
mL����Ũ����������ƣ�
�������ƹ����У�����ʵ������������Ƶ�ϡ��������ʵ���Ũ���к�Ӱ�죿������������
A��ʾ��ƫ����B��ʾ��ƫС������C��ʾ����Ӱ�족����
a������Ͳ��ȡŨ����ʱ���ӹ۲찼Һ�森
b����Ͳ��ȡŨ�������������ˮϴ��2��3�Σ�����ϴҺ��������ƿ�У�
��4���ټ����ͬѧ�ɹ�������0.400mol?L
-1�����ᣬ�����ø������кͺ�0.4g NaOH��NaOH��Һ�����ͬѧ��ȡ
mL���ᣮ
�ڼ����ͬѧ�������Ƶ������кͺ�0.4g NaOH��NaOH��Һ�����ֱȢ����������ƫС������ܵ�ԭ����
��
A��Ũ����ӷ���Ũ�Ȳ���
B��������Һʱ��δϴ���ձ�
C��������Һʱ����������ƿ�̶���
D����ˮʱ�����̶��ߣ��ý�ͷ�ι�������

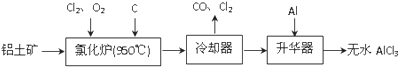


 ���100�ֵ�Ԫ�Ż�������ϵ�д�
���100�ֵ�Ԫ�Ż�������ϵ�д�
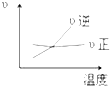
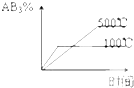
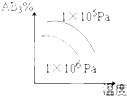

 ��ͼΪʵ����ijŨ�����Լ�ƿ��ǩ�ϵ��й����ݣ��Ը��ݱ�ǩ�ϵ��й����ݣ��ش��������⣺
��ͼΪʵ����ijŨ�����Լ�ƿ��ǩ�ϵ��й����ݣ��Ը��ݱ�ǩ�ϵ��й����ݣ��ش��������⣺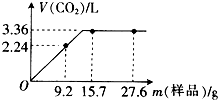 ijͬѧ��NaHCO3��KHCO3��ɵĻ�������ʵ�飮�ֳ�ȡ��ͬ�����ĸû��������ˮ�ֱ������ͬŨ�ȵ�����50mL������CO2������������״���£��������Ĺ�ϵ������ͼ��ʾ��
ijͬѧ��NaHCO3��KHCO3��ɵĻ�������ʵ�飮�ֳ�ȡ��ͬ�����ĸû��������ˮ�ֱ������ͬŨ�ȵ�����50mL������CO2������������״���£��������Ĺ�ϵ������ͼ��ʾ��