
下列叙述正确的是
A.铁表面镀锌,铁作阴极 B.钢管与电源正极连接,钢管可被保护
C.在入海口的钢铁闸门上装铜块可防止闸门被腐蚀
D.钢铁发生析氢腐蚀时,负极反应是Fe-3e-=Fe3+
科目:高中化学 来源: 题型:
臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)O3与KI溶液反应生成的两种单质是______________和________________(填分子式)。
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。已知:O3的起始浓度为0.0216 mol/L。
|
T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
①pH增大能加速O3分解,表明对O3分解起催化作用的是________。
②在30 ℃、pH=4.0条件下,O3的分解速率为________mol/(L·min)。
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为________(填字母代号)。
a.40 ℃、pH=3.0
b.10 ℃、pH=4.0
c.30 ℃、pH=7.0
查看答案和解析>>
科目:高中化学 来源: 题型:
氢气是新型能源和重要化工原料。
 已知:①2CO(g)+O2(g)=2CO2(g)
已知:①2CO(g)+O2(g)=2CO2(g) 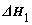 ; ②CH4(g)+2O2(g)=CO2(g)+2H2O(l)
; ②CH4(g)+2O2(g)=CO2(g)+2H2O(l) 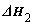
③H2(g)+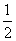 O2(g)=2H2O(l)
O2(g)=2H2O(l) 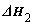
(1)科学家提出一种利用天然气制备氢气的方法:CH4(g)+CO2(g)=2CO(g)+2H2(g) 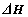
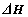 = 。这种方法的推广与使用,不仅实现资源综合利用,而且还能解决环境问题是 。
= 。这种方法的推广与使用,不仅实现资源综合利用,而且还能解决环境问题是 。
(2)氨气是重要化工原料,在国民经济中占重要地位。
①在恒温、容积相等的恒容密闭容器中投入一定量氮气、氢气,发生如下可逆反应:
N2(g)+3H2(g) 2NH3(g)
2NH3(g) 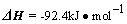
实验测得起始、平衡时的有关数据如下表所示:
| 容器编号 | 起始时各物质的物质的量/mol | 平衡时反应中的能量变化 | ||
| H2 | N2 | NH3 | ||
| I | 3 n | n | 0 | 放出热量a kJ |
| II | 3 n | 2 n | 0 | 放出热量b kJ |
| III | 6 n | 2 n | 0 | 放出热量c kJ |
下列判断正确的是 。
A.N2的转化率:II>I>III B.放出热量:a<b<92.4n
C.达到平衡时氨气的体积分数:III>I D.平衡常数:III>II>I
②在密闭恒容容器中投入一定量氮气和氢气,混合气体中氨气体积分数和温度关系如图所示:
曲线TJ段变化主要原因是 ,JL段变化的主要原因是 。氨气正反应速率:T点 L点(填:大于、小于或等于)。
③在2 L密闭容器中充入一定量的氨气,氨气的物质的量与反应时间关系如表所示:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | ••• |
| NH3/mol | 2 | 1.0 | 0.5 | 0.25 | 0.24 | 0.24 |
在该条件下,前5分钟H2平均反应速率为 。
④常温下,在V mL的a mol·L-1稀硫酸溶液中滴加b mol·L-1稀氨水V mL恰好使混合溶液呈中性。此时,一水合氨的电离常数Kb= (用含a、b代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化合物含碳、氢、氮三种元素,已知其分子内的4个氮原子排列成内空的四面体结构,且每2个氮原子间都有1个碳原子,分子中无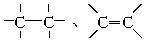 和
和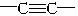 键,则此化合物的化学式是
键,则此化合物的化学式是
A.C6H12N4 B.C4H8N4 C.C6H10N4 D.C6H8N4
查看答案和解析>>
科目:高中化学 来源: 题型:
用A、B、C三种装置都可制取溴苯。请仔细分析三套装置,然后回答下列问题:
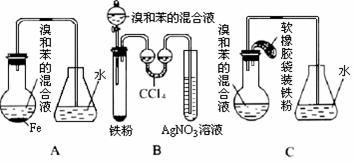
(1)写出三个装置中都发生反应的化学方程式:______________、_________________。
(2)B、C装置已连接好,并进行了气密性检验,也装入了合适的药品,接下来要使反应开始,对C应进行的操作是 ,反应过程中,B中盛放硝酸银试管中观察到的现象是 。
(3)A中存在加装药品和及时密封的矛盾,因而在实验中易造成的不良后果是:
_______________________________________________。
(4)通过以上反应得到粗溴苯后,要用如下的操作精制:
①蒸馏 ②水洗 ③用干燥剂干燥 ④10%NaOH溶液洗 ⑤水洗,正确的操作顺序 是 ____________(填下列选项)。
A ②④①⑤③ B.②④⑤③① C.④②③①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
垃圾分类有利于资源回收利用。下列垃圾归类不合理的是
| A | B | C | D | |
| 垃圾 | 废易拉罐 | 废塑料瓶 | 废荧光灯管 | 不可再生废纸 |
| 垃圾分类 |
可回收物 |
其他垃圾 |
有害垃圾 |
可燃垃圾 |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室保存下列试剂的方法不正确的是
A.钠保存在煤油中 B.用棕色试剂瓶盛放新制的氯
C.用带玻璃塞的试剂瓶盛放NaOH溶液 D.向盛放氯化亚铁溶液的试剂瓶中加少量铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
下列解释事实的化学方程式或离子方程式不正确的是
A. 用食醋除去暖水瓶中的水垢:2CH3COOH + CaCO3 ═ Ca2+ + 2CH3COO- + CO2↑+ H2O
B. 自然界各种原生铜的硫化物经氧化、淋滤作用后产生的硫酸铜,遇到难溶的PbS,慢慢转变为铜蓝(CuS):Cu2+ + SO42- + PbS ═ CuS + PbSO4
C. 在盐碱地(含较多NaCl、Na2CO3)上通过施加适量CaSO4,可降低土壤的碱性:
CaSO4 + Na2CO3 ═ CaCO3↓+ Na2SO4
D. 在燃煤时加入适量石灰石,可减少SO2的排放: 2CaCO3 + O2 + 2SO2 ═ 2CaSO3 + 2CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
C、N、S是重要的非金属元素,按要求回答下列问题:
(1)烟道气中含有的CO和SO2是重要的污染物,可在催化剂作用下将它们转化为S(s)和CO2,此反应的热化学方程式为______________________________________。
已知:CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ·mol-1;
S(s)+O2=SO2(g) △H=-296.0 kJ·mol-1
(2)向甲、乙两个均为1L的密闭容器中,分别充入5mol SO2和3mol O2,发生反应:
2 SO2 (g)+O2 (g) 2SO3(g) △H<0。甲容器在温度为T1的条件下反应,达到平衡时SO3的物质的量为4.5mol;乙容器在温度为T2的条件下反应,达到平衡时SO3的物质的量为4.6mol。
2SO3(g) △H<0。甲容器在温度为T1的条件下反应,达到平衡时SO3的物质的量为4.5mol;乙容器在温度为T2的条件下反应,达到平衡时SO3的物质的量为4.6mol。
则T1________T2(填“>”“<”),甲容器中反应的平衡常数K=___________。
(3)如图所示,A是恒容的密闭容器,B是一个体积可变的充气气囊。保持恒温,关闭K2,分别将1 mol N2和3mol H2通过K1、K3充入A、B中,发生的反应为:
N2(g)+3H2(g)  2NH3(g),起始时A、B的体积相同均为a L。
2NH3(g),起始时A、B的体积相同均为a L。

①下列示意图正确,且既能说明A容器中反应达到平衡状态,又能说明B容器中反应达到平衡状态的是_ __。
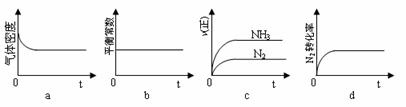
②容器A中反应到达平衡时所需时间t s,达到平衡后容器的压强变为原来的5/6,则平均反应速率v(H2)=____。
(4)将0.1mol氨气分别通入1L pH=1的盐酸、硫酸和醋酸溶液中,完全反应后三溶液中NH4+离子浓度分别为c1、c2、c3,则三者浓度大小的关系为_______ (用c1、c2、c3和>、<、=表示)。已知醋酸铵溶液呈中性,常温下CH3COOH的Ka=1×10-5 mol·L-1,则该温度下0.1 mol·L-1的NH4Cl溶液的pH为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com