
在恒温恒容条件下,有反应2A(g)+2B(g)  C(g)+3D(g),现分别从两条途径建立平衡:I.A、B的起始浓度均为2 mol·L-1 Ⅱ.C、D的起始浓度分别为2 mol·L-1和6 mol·L-1.下列说法正确的是(
)
C(g)+3D(g),现分别从两条途径建立平衡:I.A、B的起始浓度均为2 mol·L-1 Ⅱ.C、D的起始浓度分别为2 mol·L-1和6 mol·L-1.下列说法正确的是(
)
A.达到平衡时,I途径的反应速率和Ⅱ途径的反应速率相同
B.达平衡时,体系内混合气体的平均密度相同
C.I、Ⅱ两途径达到平衡时,体系内混合气体的百分组成相同
D.I、Ⅱ两途径达到平衡时,体系内混合气体的平均相对分子质量不同
C
【解析】
试题分析:恒温恒容时,反应前后计量数不变的反应,若起始投料量比值相等,则两平衡等效。II中C、D的起始浓度分别为2 mol·L-1和6 mol·L-1相当于A、B的起始浓度均为4mol/L。I中A、B起始浓度均为2mol/L,达平衡时,II途径的反应速率比I途径快,A错误;达到平衡时,II中混合气体的密度是I的2倍,B错误;两途径达到平衡时是等效平衡,平衡时混合气体的百分组成相同、混合气体的平均相对分子质量相同,C正确、D错误。
考点: 等效平衡
点评:定温定容建立等效平衡的条件是投料量相等,对于反应前后气体化学计量数不变的反应,建立等效平衡的途径是起始投料量比值相等。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元 素 | 有关信息 |
| A | 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | M层上有3个电子 |
| D | 短周期原子半径最大的主族元素 |
| E | 最高正价与最低负价代数和为6 |

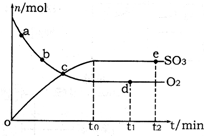
 A2O4(g);△H<0.在恒温恒容条件下,将一定量AO2和A2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示.
A2O4(g);△H<0.在恒温恒容条件下,将一定量AO2和A2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
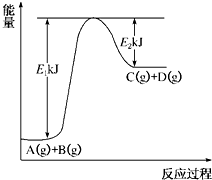 已知某反应A(g)+B(g)?C(g)+D(g)进行过程中的能量变化如图所示,请回答下列问题:
已知某反应A(g)+B(g)?C(g)+D(g)进行过程中的能量变化如图所示,请回答下列问题:| A | B | C | D | |
| 甲 | a mol | a mol | 0 | 0 |
| 乙 | 2a mol | a mol | 0 | 0 |
| 丙 | a mol | a mol | a mol | a mol |
| 丁 | a mol | 0 | a mol | a mol |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广西南宁九中高二上学期段考理科化学试卷(带解析) 题型:单选题
在恒温恒容条件下,有反应2A(g)+2B(g) 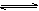 C(g)+3D(g),现分别从两条途径建立平衡:I.A、B的起始浓度均为2 mol·L-1 Ⅱ.C、D的起始浓度分别为2 mol·L-1和6 mol·L-1.下列说法正确的是( )
C(g)+3D(g),现分别从两条途径建立平衡:I.A、B的起始浓度均为2 mol·L-1 Ⅱ.C、D的起始浓度分别为2 mol·L-1和6 mol·L-1.下列说法正确的是( )
A.达到平衡时,I途径的反应速率和Ⅱ途径的反应速率相同
B.达平衡时,体系内混合气体的平均密度相同
C.I、Ⅱ两途径达到平衡时,体系内混合气体的百分组成相同
D.I、Ⅱ两途径达到平衡时,体系内混合气体的平均相对分子质量不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com