
分析 甲、乙、丙、丁分别是盐酸、碳酸钠、氯化钙、硝酸银4种溶液中的一种.将它们两两混合后,由复分解反应可知,只有硝酸银与其它三种物质混合均生成白色沉淀,而只有碳酸钠与盐酸反应生成气体,以此来解答.
解答 解:甲、乙、丙、丁分别是盐酸、碳酸钠、氯化钙、硝酸银4种溶液中的一种.将它们两两混合后,由复分解反应可知,只有硝酸银与其它三种物质混合均生成白色沉淀,而只有碳酸钠与盐酸反应生成气体,结合③丁与乙混合产生无色气体,则丁、乙一定为盐酸、碳酸钠中的一种,②丙与乙或丁混合也产生沉淀,则丙为AgNO3;
①甲与乙或丙混合都产生沉淀,则甲为CaCl2,乙为Na2CO3,丁为HCl,
(1)丁与乙反应的离子方程式为CO32-+2H+=CO2↑+H2O,故答案为:CO32-+2H+=CO2↑+H2O;
(2)由上述分析可知,甲为CaCl2,乙为Na2CO3,丙为AgNO3,丁为HCl,故答案为:CaCl2;Na2CO3;AgNO3;HCl.
点评 本题考查无机物的推断,为高频考点,把握丙为硝酸银及复分解反应的现象为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的综合应用,题目难度中等.


科目:高中化学 来源: 题型:解答题
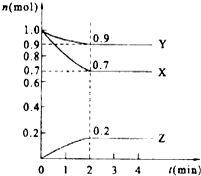 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水中含有钾元素,只需经过物理变化就可以得到钾单质 | |
| B. | 海水蒸发制海盐的过程中发生了化学变化 | |
| C. | 利用潮汐发电是将化学能转化为电能 | |
| D. | 从海水中可以得到NaCl,电解熔融NaCl可制备金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
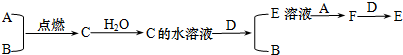
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮气化学性质不活泼,可用作食品防腐剂 | |
| B. | 硅胶无毒、无味、无腐蚀性,可用作食品干燥剂 | |
| C. | SiO2、Al2O3、MgO都有很高的熔点,可以制耐火材料 | |
| D. | 二氧化锰具有强氧化性,可用作H2O2分解的氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:3 | C. | 3:4 | D. | 4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com