
| A. | 苯、油脂均不能使酸性KMnO4溶液褪色 | |
| B. | 往蔗糖与稀硫酸共热后的溶液中滴加银氨溶液,再水浴加热,能看到银镜生成 | |
| C. | 淀粉和纤维素的分子式均为(C6H10O5)n,二者互为同分异构体 | |
| D. | 向鸡蛋清溶液中加硫酸铵饱和溶液,有沉淀析出,再加水沉淀溶解 |
分析 A.不饱和油脂中含有不饱和烃基,可与高锰酸钾发生反应;
B.银镜反应必须在碱性条件下进行;
C.淀粉与纤维素中的n值不同;
D.蛋白质遇到浓的无机盐溶液发生盐析,盐析是可逆的.
解答 解:A.苯不能使酸性高锰酸钾褪色,不饱和油脂中含有C=C官能团,可与酸性高锰酸钾发生氧化还原反应而使高锰酸钾褪色,故A错误;
B.向蔗糖水解后的溶液中加银氨溶液并水浴加热,无银镜生成,是因检验水解产物葡萄糖应在碱性溶液中进行,故B错误;
C.淀粉与纤维素中的n值不同,分子式不同,不是同分异构体,故C错误;
D.向鸡蛋清溶液中加硫酸铵饱和溶液发生盐析,有沉淀析出,加入水后沉淀溶解,故D正确;
故选D.
点评 本题主要考查有机物的结构和性质,题目难度不大,本题注意把握有机物的官能团的性质的判断.


 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①③④⑤ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化锰具有强氧化性,可作双氧水分解的氧化剂 | |
| B. | 浓硫酸具有较强酸性,常用作淀粉水解的催化剂 | |
| C. | 碳具有还原性,一定条件下能将二氧化硅还原为硅 | |
| D. | 二氧化硫具有漂白性,与氯水混合使用效果更好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 104 | 66 |
| 主要化合价 | +2 | +3 | +6、+4、-2 | -2 |
| A. | X、Y元素的金属性 X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW3 | |
| C. | Y的氧化物对应的水化物一种是强酸 | |
| D. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性的透明溶液中:K+、SO42-、NO3-、Fe3+ | |
| B. | 在KMnO4溶液中:SO42-、Mg2+、NO3-、CH3CH2OH | |
| C. | 常温下由水电离出的c(H+)?c(OH-)=10-20的溶液中:Na+、NH4+、Cl-、SiO32- | |
| D. | 离子物质的量浓度相同的溶液中:CH3COO-、SO42-、NH4+、Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
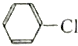 的水解反应均有醇生成.
的水解反应均有醇生成.| A. | 全都正确 | B. | 除⑤ | C. | 除⑥ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
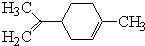
| A. | 它的一氯代物有9种(不考虑立体异构) | |
| B. | 它的分子中最多有7个原子共平面 | |
| C. | 一定条件下,它分别可以发生加成、取代、氧化、还原反应 | |
| D. | 它和丁基苯(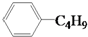 )互为同分异构体 )互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol CO、 2mol H2 | 1mol CH3OH | 2mol CO、 4mol H2 |
| CH3OH的浓度/mol•L-1 | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 反应物转化率 | α1 | α2 | α3 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2-、Cl-、K+ | B. | Cl-、Na+、Al3+ | C. | Na+、Mg2+、F- | D. | O2-、Mg2+、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com