
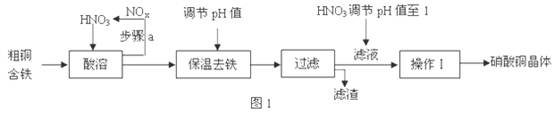
| | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe3+ Cu2+ | 1.9 4.7 | 3.2 6.7 |
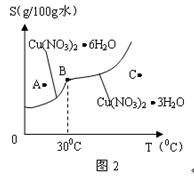
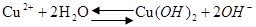


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.用有机溶剂可萃取海水中的溴、碘 |
| B.海水中含有碘元素,只需将海水中的碘升华就可以得到碘单质 |
| C.从海水中可以得到NaCl,NaCl可以是制造化肥的原料 |
| D.常用电解氯化钠和氯化镁的水溶液来制得钠和镁 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.改变金属内部组成结构,可以增强金属耐腐蚀的能力 | B.涂油漆 |
| C.外加电流阴极保护法 | D.在金属表面覆盖一层保护层 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
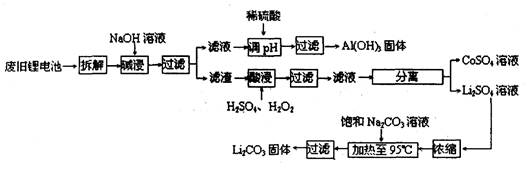
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ,含
,含 、
、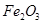 、MgO等杂质)中提取Al2O3的两种工艺品流程如下:
、MgO等杂质)中提取Al2O3的两种工艺品流程如下: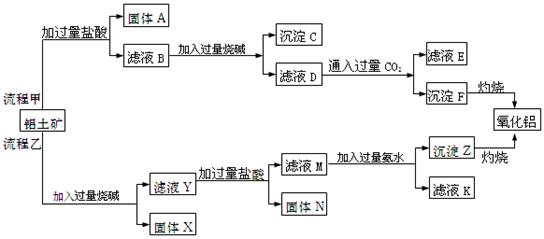
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②③ | B.②④ | C.③④ | D.①③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 研究的一项重要任务。
研究的一项重要任务。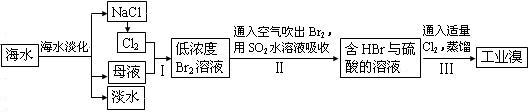
 ②在3mL溴水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象为右图中 ▲ 。
②在3mL溴水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象为右图中 ▲ 。
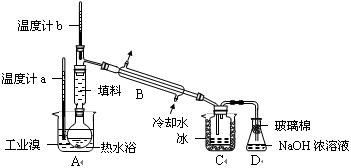
 请你参与分析讨论:
请你参与分析讨论: 为除去该产物中仍残留的少量Cl2,可向其中加入 ▲ 溶液,充分反应后,再进行的分离操作是 ▲ 。
为除去该产物中仍残留的少量Cl2,可向其中加入 ▲ 溶液,充分反应后,再进行的分离操作是 ▲ 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com