
【题目】燃烧产生的尾气中含有一定量的NO。科学家们设计了一种间接电处理法除去其中NO的装置,如下图所示,它可以将NO转化为NH4+。下列说法正确的是

A. a连接电源的正极
B. Pt电极B上发生的电极反应为2H2O-4eˉ=O2↑+4H+
C. 当NO吸收柱中产生1mol SO32ˉ时,理论上处理的NO气体的体积为8.96L(标准状况)
D. 图中的离子交换膜应为阴离子交换膜
【答案】B
【解析】
根据图示,SO32ˉ在电极A上反应生成S2O42ˉ,反应中S元素的化合价由+4价变成+3价,化合价降低被还原,因此A为阴极,则B为阳极,在NO吸收柱中NO与S2O42ˉ反应生成氮气和SO32ˉ,据此分析解答。
A. 根据上述分析,A为阴极,B为阳极,a连接电源的负极,故A错误;
B. Pt电极B为阳极,发生氧化反应,电极反应为2H2O-4eˉ=O2↑+4H+,故B正确;
C. 当NO吸收柱中产生1mol SO32ˉ时,反应中消耗0.05molS2O42ˉ,转移1mol电子,根据得失电子守恒,处理的NO气体为0.5mol,标准状况下的体积为11.2L,故C错误;
D. 根据图示,阳极区硫酸的浓度基本不变,结合电极B的反应为2H2O-4eˉ=O2↑+4H+,生成的氢离子需要向阴极区运动,离子交换膜应为阳离子交换膜,故D错误;故选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】关于容量瓶的使用,下列说法中错误的是
A. 不能在容量瓶中溶解固体或稀释浓溶液
B. 容量瓶不能加热
C. 容量瓶可以用来长期存放溶液
D. 容量瓶不能作为反应容器
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与环境密切相关,下列有关说法正确的是( )
A.酸雨是pH小于7的雨水
B.汽车尾气中排放的氮氧化合物主要是汽油燃烧产生的
C.CO2、NO2或SO2都会导致酸雨的形成
D.大气中CO2含量的增加会导致温室效应加剧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组以 H2O2 分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响,在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2 溶液 | 无 |
② | 10 mL 5% H2O2 溶液 | 无 |
③ | 10 mL 5% H2O2 溶液 | 1 mL 0.1 mol L-1 FeCl3 溶液 |
④ | 10 mL 5% H2O2 溶液+少量 HCl 溶液 | 1 mL 0.1 mol L-1 FeCl3 溶液 |
⑤ | 10 mL 5% H2O2 溶液+少量 NaOH溶液 | 1 mL 0.1 mol L-1 FeCl3 溶液 |
(1)催化剂能加快化学反应速率的原因是_____。
(2)实验①和②的目的是_________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下 H2O2 稳定,不易分解。为了达到实验目的,你对原实验方案的改进是_____。
(3)写出实验③的化学反应方程式:_____。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析如图能够得出的实验结论是_____。
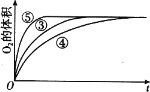
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘元素,某学习小组设计如下实验流程提取海带中的碘,请回答下列问题:
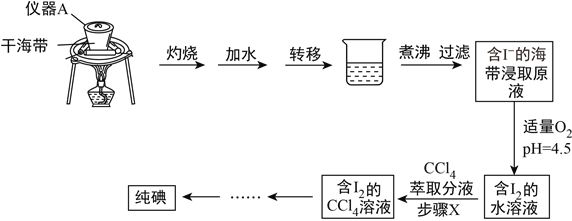
(1)仪器A的名称为__________________,实验室取用仪器A必须使用_________。
(2)煮沸的作用是______________________。
(3)步骤X中,使用了分液漏斗。分液漏斗使用前,须进行的操作是__________;萃取后,分液漏斗内观察到的现象是___________;分液时,为了保证液体顺利留下,应首先_________。
(4)向海带浸取原液中通入适量O2,并控制溶液pH为4.5,此时发生反应的离子反应方程式为:__________________________________________。
(5)某同学欲采用蒸馏含I2的CCl4溶液得到纯碘,此方案不合理,理由是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种粒子。其中N2、ClO-的物质的量随时间变化的曲线如图所示。下列判断不正确的是

A. 该反应的氧化剂是ClO-
B. 消耗1mol还原剂,转移3mol电子
C. 氧化剂与还原剂的物质的量之比为2:3
D. 该离子方程式为3ClO-+2NH4+=2H++N2↑+3Cl-+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1L某溶液中含有0.1molKCl和0.1mol CaCl2,此溶液中Cl-的物质的量浓度为
A. 3mol/L B. 0.2mol/L C. 0.3mol/L D. 0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:
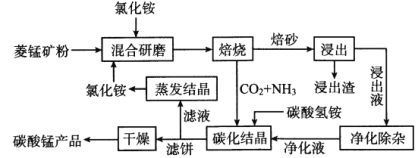
已知:①菱锰矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
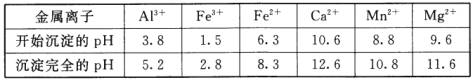
②相关金属离子[c0(Mn+)=0.1mol/L]形成氢氧化物沉淀的pH范围如下:
③常温下,CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11。
回答下列问题:
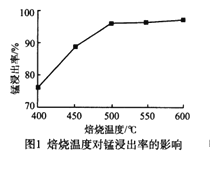
(1)“焙烧”时发生的主要反应的化学方程式为_________。
分析下列图1,氯化铵焙烧菱锰矿的最佳条件是:焙烧温度为500℃。分析选择反应温度为500℃的原因_________________。
(2)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为_________;再调节溶液的pH将Al3+、Fe3+变为沉淀除去,溶液pH的范围为_________;然后加入NH4F将Ca2+、Mg2+变为CaF2、MgF2沉淀除去,两种沉淀共存时溶液中![]() =_________。
=_________。
(3)碳化结晶时,反应的离子方程式为_________。
(4)MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示,300℃—770℃范围内,发生反应的化学方程式为________________________。
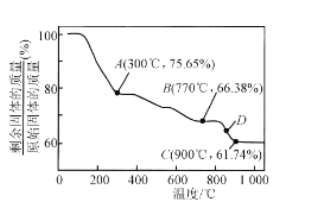
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁原子电池放电时电压高而平稳,电池反应为xMg + Mo3S4 ![]() MgxMo3S4,下列说法错误的是
MgxMo3S4,下列说法错误的是
A. 放电时负极反应为Mg-2e-===Mg2+
B. 充电时阳极反应为Mo3S4+xMg2++2xe-===MgxMo3S4
C. 放电时Mg2+向正极区移动
D. 充电时电池的负极接充电电源的负极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com