
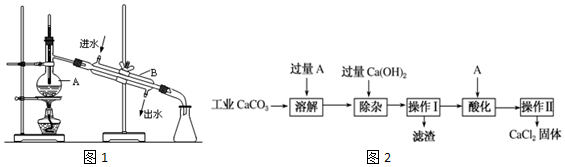
分析 (1)实验室用自来水制备少量蒸馏水,实验方法为蒸馏,图中A仪器为蒸馏烧瓶,B为冷凝管;
(2)装置图分析可知温度计水银球应在蒸馏烧瓶的支管口处,冷凝器水流方向逆流;
(3)混合溶液加热需要防止爆沸;
(4)工业碳酸钙加入过量的盐酸溶解生成氯化钙,溶液中含有少量FeCl3杂质,加入过量的氢氧化钙沉淀铁离子,过滤得到滤渣为氢氧化铁沉淀,溶液酸化加入盐酸除去过量的氢氧化钙,得到溶液蒸发得到氯化钙固体,
①分析可知滤渣中所含主要物质的化学式为Fe(OH)3 ,试剂A是盐酸;
②加A进行酸化的目的是除去过量的Ca(OH)2;
③操作Ⅰ是过滤操作,装置安装时从下到上,从左到右;
解答 解:(1)实验室用自来水制备少量蒸馏水,制备方法的名称为蒸馏,图中A仪器为蒸馏烧瓶,B为冷凝管,
故答案为:蒸馏,蒸馏烧瓶,冷凝管;
(2)装置图分析可知温度计水银球应在蒸馏烧瓶的支管口处,冷凝器水流方向逆流,装置中两处主要错误之处温度计的水银球没有在蒸馏烧瓶的支管口处;冷凝水的流向没有下口进上口出,
故答案为:温度计的水银球没有在蒸馏烧瓶的支管口处;冷凝水的流向没有下口进上口出;
(3)实验中A中除了加入适量蒸馏水,混合溶液加热需要防止爆沸,还要加入的物质是碎瓷片(沸石),
故答案为:碎瓷片(沸石);防暴沸;
(4)①流畅分析可知,滤渣中所含主要物质的化学式为Fe(OH)3 ,试剂A是盐酸,
故答案为:Fe(OH)3;稀盐酸;
②上述流程中,加A进行酸化的目的是除去过量的Ca(OH)2,
故答案为:除去过量的Ca(OH)2;
③操作Ⅰ是过滤操作,需要用到的玻璃仪器有:玻璃棒、烧杯、漏斗,实验室进行CaCl2溶液蒸发时,一般有以下操作过程 ①放置酒精灯;②停止加热;③加热搅拌;④放上蒸发皿(蒸发皿中盛有NaCl溶液)⑤固定铁圈位置.其正确的操作顺序为:①⑤④③②,
故答案为:玻璃棒、烧杯、漏斗;①⑤④③②;
点评 本题考查了物质分离提纯、实验基本操作、仪器使用、物质性质的分析判断,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1 mol N2所含有的原子数为NA | |
| B. | 标准状况下,22.4 L水中含有的水分子数为NA | |
| C. | 标准状况下,22.4 LHF所含的分子数为NA | |
| D. | 24 g O2分子和24 g O3分子所含的分子数不相等,氧原子数目相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与稀盐酸的反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 氢氧化钡与稀硫酸的反应:Ba2++SO42-═BaSO4↓ | |
| C. | 铜溶于浓硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | 将小苏打加入到氢氧化钠溶液中:OH-+HCO3-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 酸 | H2C2O4 | HF | H2CO3 | H3BO3 |
| 电离平衡常数Ka | Ka1=5.9×10-2 Ka2=6.4×10-5 | 未知 | Ka1=4.2×10-7 Ka2=5.6×10-11 | 5.8×10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 19:8 | B. | 22:1 | C. | 13:8 | D. | 8:13 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 回答下列问题
回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫氰酸钾溶液 | B. | NaOH溶液 | ||
| C. | 新制氯水、硫氰酸钾溶液 | D. | 酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 2SO3.
2SO3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com