
【题目】实验室制取氯气的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。结合氯气的物理性质,判断下列叙述中不正确是________________(填序号)。
MnCl2+Cl2↑+2H2O。结合氯气的物理性质,判断下列叙述中不正确是________________(填序号)。
①加热盛有二氧化锰、浓盐酸的烧瓶,瓶内充满黄绿色气体。
②氯气的密度比空气大,常用向上排空气法收集氯气。
③闻氯气气味时,用手轻轻在集气瓶口扇动,使极少量氯气飘进鼻孔。
④在充满氯气的集气瓶内加水,盖严后振荡,瓶内气体颜色变浅,液体变为黄绿色。
⑤氯气易液化,在低温和加压的条件下可以转变为液态(液氯)和固态。
⑥氯气、氯水、液氯是同一种物质,只是状态不同,都属于纯净物。
【答案】⑥
【解析】
结合氯气的物理性质和化学性质解题即可。
①二氧化锰和浓盐酸混合加热可制得氯气,而氯气是黄绿色有强烈刺激性气味的有毒气体,故①正确;
②氯气易溶于水且与水反应,可根据其密度比空气大,选择向上排空气法收集氯气,故②正确;
③氯气是有毒气体,则闻氯气气味时,用手轻轻在集气瓶口扇动,使极少量氯气飘进鼻孔,故③正确;
④氯气溶于水所得氯水中含有氯气分子,则在充满氯气的集气瓶内加水,盖严后振荡,瓶内气体颜色变浅,液体变为黄绿色,故④正确;
⑤氯气的熔、沸点比较高,在低温和加压的条件下,氯气易转变为液态(液氯)和固态,故⑤正确;
⑥氯气、液氯是同一种物质,只是状态不同,都属于纯净物,但氯水是氯气的水溶液,属于混合物,故⑥错误;
故答案为⑥。


科目:高中化学 来源: 题型:
【题目】某课外活动小组为了测定铜铁合金中铁的质量分数,现取铜铁合金样品20.0 g,将80.0 g稀硫酸平均分成4份,分4次逐渐加入到样品中,每次充分反应后测得剩余固体质量见下表
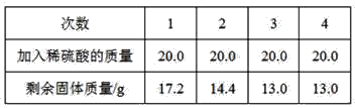
试求:
(1)20.0 g铜铁合金中,铜的质量是______。
(2)铜铁合金中,铁元素的质量分数是______。
(3)20 g稀硫酸溶液中溶质质量是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳的氧化物对环境的影响较大,研究和开发碳的氧化物的应用对发展低碳经济,构建生态文明社会具有重要的意义。
(1)已知:①甲醇的燃烧热ΔH=-726.4 kJ·mol-1;
②H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1
则二氧化碳和氢气合成液态甲醇、生成气态水的热化学方程式为_____________。
(2)在T1时,向体积为2L的恒容容器中充入物质的量之和为3mol的CO和H2,发生反应CO(g)+2H2(g)CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与![]() 的关系如图所示:
的关系如图所示:
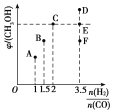
①当起始![]() =2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=______。若此刻再向容器中加入CO(g)和CH3OH(g)各0.4mol,达到新平衡时H2的转化率将________(填“增大”“减小”或“不变”)。
=2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=______。若此刻再向容器中加入CO(g)和CH3OH(g)各0.4mol,达到新平衡时H2的转化率将________(填“增大”“减小”或“不变”)。
②当![]() =3.5时,达到平衡后,CH3OH的体积分数可能是图像中的________(填“D”“E”或“F”)点。
=3.5时,达到平衡后,CH3OH的体积分数可能是图像中的________(填“D”“E”或“F”)点。
(3)已知由CO2生成CO的化学方程式为CO2(g)+O(g)CO(g)+O2(g),其正反应速率为v正=k正·c(CO2)·c(O),逆反应速率为v逆=k逆·c(CO)·c(O2),k为速率常数。2500 K时,k逆=1.21×105L·s-1·mol-1,k正=3.02×105L·s-1·mol-1,则该温度下该反应的平衡常数K为________。(保留小数点后一位小数)
(4)CH3OH—O2在新型聚合物催化下可发生原电池反应,其装置如图:
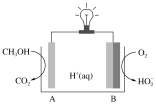
①外电路中每转移3mol电子,溶液中生成_______molH+
②写出电极B的电极反应式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠是一种淡黄色固体,能与水反应,常用在呼吸面具和潜水艇里作为氧气的来源,还可用作熔矿剂,使某些不溶于酸的矿物分解。用脱脂棉包住约0.2 g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来。
请回答:(1)由实验现象所得出的有关过氧化钠与水反应的结论是:
a.有氧气生成;b.__________。
(2)某研究性学习小组拟用如图所示装置进行实验,以证明上述结论。
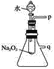
①用以验证结论a的实验方法是:__________;
②用以验证结论b的实验方法是:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向200 mL 6 mol/L的盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准状况下测定)。请回答下列问题:
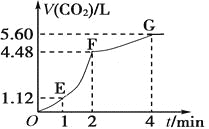
(1)设OE段的反应速率为v1,EF段的反应速率为v2,FG段的反应速率为v3,则速率从大到小的顺序为____________________________。(用v1、v2、v3表示)
(2)为了减缓上述反应的速率,欲向该溶液中加入下列物质,你认为可行的是_________(填字母)。
A.蒸馏水 |
B.氯化钾固体 |
C.氯化钠溶液 |
D.浓盐酸 |
E.降低温度
F.减少CaCO3
(3)若反应过程中溶液体积的变化忽略不计,计算FG段用盐酸表示的化学反应速率是多少?(写出计算过程):________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:
实验 序号 | 实验温 度/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间/s | ||||
KMnO4溶 液(含硫酸) | H2C2O4溶液 | H2O | |||||
V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t1 |
(1)通过实验A、B,可探究出_____(填外部因素)的改变对反应速率的影响,其中V1=_____,T1=______;通过实验________可探究出温度变化对化学反应速率的影。
(2)若t1<8,则由此实验可以得出的结论是_________;利用实验B中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=______。
(3)该反应中有无色无味气体产生且锰被还原为Mn2+,写出相应反应的离子方程式__________。
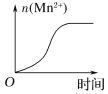
(4)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间变化的趋势如图所示,并认为造成此种变化的原因是反应体系中的某种粒子对KMnO4与草酸之间的反应有某种特殊的作用,则该作用是___________,相应的粒子最可能是(填序号)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1 mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1 mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4(s)·5H2O(s)受热分解的化学方程式为CuSO4·5H2O(s)![]() CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是( )
CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是( )
A. ΔH2>ΔH3 B. ΔH1<ΔH3 C. ΔH1+ΔH3=ΔH2 D. ΔH1+ΔH2>ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。请设计实验,得出正确结论。
(1)提出问题:
氯水中何种物质能使湿润的红色布条褪色?
(2)收集资料:
①氯气有强氧化性
②氯气与水反应生成盐酸和次氯酸
③次氯酸有强氧化性
(3)提出假设:
①__;
②__;
③___;
④水使红色布条褪色
(4)验证假设:
实验①:把红色干布条放入充满氯气的集气瓶中,布条不褪色;
实验②:__;
实验③:把红色布条放在水里,布条不褪色。
(5)得出的实验结论__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数。已知①Al4C3与硫酸反应可生成CH4;②AlN溶于强酸产生铵盐,溶于强碱生成氨气(忽略NH3在强碱性溶液中的溶解);③该实验条件下的气体摩尔体积为Vm L/mol,实验装置如下(量气管为碱式滴定管改装)
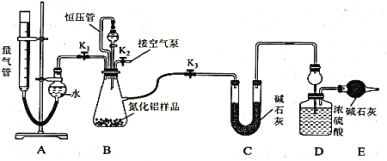
实验过程:连好装置后,检验装置的气密性;称得装置D的初始质量为ag;称取bg AlN样品置于装置B的锥形瓶中,各装置中加入相应药品,重新连好装置;读取量气管中液面的初始读数为x mL(量气装置左右液面相平)。
(1)①若先测量Al4C3质量分数,对K1、K2、K3三个活塞的操作是关闭活塞______,打开活塞______。
②当_____时,说明反应已经结束。读取读数之前,应对量气管进行的操作为____________;若量气管中的液面高于右侧球形容器中的液面,所测气体体积______(填“偏大”、“偏小”或“无影响”)。
③记录滴定管的读数为y mL,则Al4C3的质量分数为_________(用可能含a、b、x、y、Vm的代数式表示)。
④若无恒压管,对所测Al4C3质量分数的影响是______(填“偏大”、“偏小”或“无影响”)。
(2)若先测量AlN质量分数:首先关闭活塞K1,打开活塞K3,通过分液漏斗加入过量的某物质,写出AlN与过量的某物质发生反应的离子方程式为__________;反应完成后,__________(填该步应进行的操作),最后称得装置D的质量为cg,进而测量AlN的质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com