
| 混合物 | 需加入的试剂 | 分离方法 |
| 苯(苯酚) | ||
| 乙烷(乙烯) | c | C |
| 乙醇(水) | e | |
| 乙酸乙酯(乙酸) |
分析 苯酚与NaOH溶液反应后,与苯分层;
乙烯与溴水反应,而乙烷不能;
CaO与水反应后,增大与乙醇的沸点差异;
乙酸与碳酸钠反应后,与乙酸乙酯分层.
解答 解:苯酚与NaOH溶液反应后,与苯分层,则加NaOH溶液、分液可分离;
乙烯与溴水反应,而乙烷不能,则选溴水、洗气可分离;
CaO与水反应后,增大与乙醇的沸点差异,则加CaO后蒸馏即可;
乙酸与碳酸钠反应后,与乙酸乙酯分层,则选饱和碳酸钠、分液可分离,
故答案为:
| 混合物 | 需加入的试剂 | 分离方法 |
| 苯(苯酚) | b | A |
| 乙烷(乙烯) | c | C |
| 乙醇(水) | e | D |
| 乙酸乙酯(乙酸) | d | A |
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及混合物分离方法等为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH2CH2Cl | B. |  | ||
| C. |  | D. | 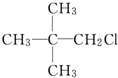 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 和
和
 和
和

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. ;⑤n CH2=CHCH2COOH$\stackrel{催化剂}{→}$
;⑤n CH2=CHCH2COOH$\stackrel{催化剂}{→}$ .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | M与X形成的化合物对应的水化物一定是强酸 | |
| B. | Y2X和Y2X2中阴、阳离子的个数比相同,化学键类型也完全相同 | |
| C. | X、Y的简单离子半径:r(X2-)>r(Y+) | |
| D. | X的气态氢化物比M的气态氢化物稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
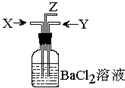 碳跟浓硫酸共热产生的气体X和二氧化锰跟浓盐酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是…( )
碳跟浓硫酸共热产生的气体X和二氧化锰跟浓盐酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是…( )| A. | 洗气瓶中产生的沉淀是碳酸钡 | |
| B. | 在Z导管出来的气体中无二氧化碳 | |
| C. | 洗气瓶中产生的沉淀是硫酸钡 | |
| D. | 洗气瓶中产生的沉淀是碳酸钡和亚硫酸钡 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com