
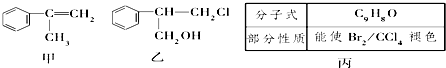
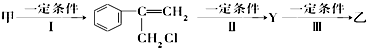
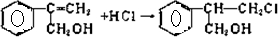 (不需注明反应条件).
(不需注明反应条件).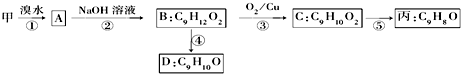
 .
. 、
、 、
、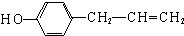 (任写一种).
(任写一种).分析 (1)乙中官能团是氯原子、羟基;
(2)甲和HCl发生加成反应生成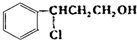 ,
,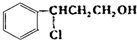 发生催化氧化反应生成Y,Y结构简式为
发生催化氧化反应生成Y,Y结构简式为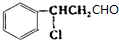 ,Y发生消去反应生成乙;
,Y发生消去反应生成乙;
(3)甲和溴水发生加成反应生成A,A的结构简式为: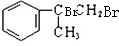 ,
,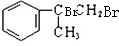 和氢氧化钠的水溶液发生取代反应生成B,B的结构简式为:
和氢氧化钠的水溶液发生取代反应生成B,B的结构简式为: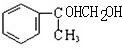 ,B被氧化生成C,则C的结构简式为:
,B被氧化生成C,则C的结构简式为: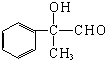 ,丙能使溴褪色,说明丙中含有碳碳双键,C发生消去反应生成丙,则丙的结构简式为:
,丙能使溴褪色,说明丙中含有碳碳双键,C发生消去反应生成丙,则丙的结构简式为: ,B发生消去反应生成D,D的结构简式为:
,B发生消去反应生成D,D的结构简式为: .
.
解答 解:(1)甲、乙中含氧官能团的名称分别为醇羟基、醛基,故答案为:醇羟基;醛基;
(2)甲和HCl发生加成反应生成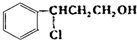 ,
,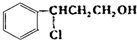 发生催化氧化反应生成Y,Y结构简式为
发生催化氧化反应生成Y,Y结构简式为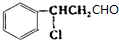 ,Y发生消去反应生成乙;
,Y发生消去反应生成乙;
I的反应类型是取代反应;II的反应类型是消去反应,条件是NaOH的水溶液、加热,Ⅲ为碳碳双键与HCl的加成反应,该反应为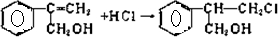 ;
;
故答案为:取代反应;氢氧化钠水溶液、加热;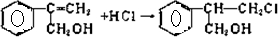 ;
;
(3)甲和溴水发生加成反应生成A,A的结构简式为: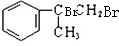 ,
,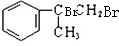 和氢氧化钠的水溶液发生取代反应生成B,B的结构简式为:
和氢氧化钠的水溶液发生取代反应生成B,B的结构简式为: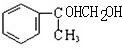 ,B被氧化生成C,则C的结构简式为:
,B被氧化生成C,则C的结构简式为: ,丙能使溴褪色,说明丙中含有碳碳双键,C发生消去反应生成丙,则丙的结构简式为:
,丙能使溴褪色,说明丙中含有碳碳双键,C发生消去反应生成丙,则丙的结构简式为: ,B发生消去反应生成D,D的结构简式为:
,B发生消去反应生成D,D的结构简式为: ;
;
①B为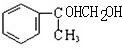 ,可与钠、HBr发生反应,与氯化铁、碳酸钠不反应,
,可与钠、HBr发生反应,与氯化铁、碳酸钠不反应,
故答案为:bc;
②由以上分析可知丙为 ,故答案为:
,故答案为: ;
;
③D的结构简式为: ,D的结构简式符合下列条件:
,D的结构简式符合下列条件:
a.苯环上的一氯代物有两种说明苯环上含有两类氢原子;
b.遇FeCl3溶液发生显色反应说明含有酚羟基;
c.能与Br2/CCl4发生加成反应说明含有碳碳不饱和键,
则符合条件的D的同分异构体有: 、
、 、
、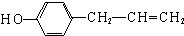 ,所以有3种同分异构体,
,所以有3种同分异构体,
故答案为:3; 、
、 、
、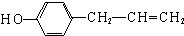 (任写一种).
(任写一种).
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,明确有机物官能团结构和性质关系是解本题关键,注意结合反应条件进行推断,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下:
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下: +HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50-60℃}$
+HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50-60℃}$ +H2O
+H2O 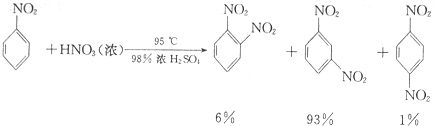
| 物质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 1,3-二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于水 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 所有物质之间均存在化学键 | |
| C. | 由非金属元素可以组成离子化合物 | |
| D. | 不同元素组成的多原子分子里的化学键一定为极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
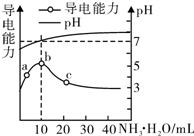
| A. | a~b点导电能力增强说明HR为弱酸 | |
| B. | b点溶液pH=7说明NH4R没有水解 | |
| C. | c点溶液存在c( NH4+)>c( R-)、c(OH-)>c(H+) | |
| D. | b~e任意点溶液均有c(H+)×c(OH-)=Kw=l.0×l0-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
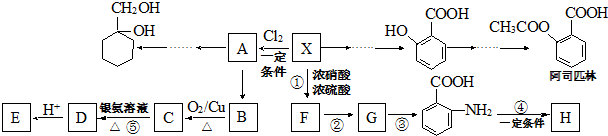
 (苯胺,易被氧化)
(苯胺,易被氧化)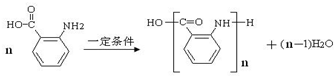 .
.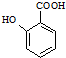 的同系物M比其本身相对分子质量大14,M的同分异构体中能同时满足以下条件:①芳香族化合物,②能发生水解反应,③与FeCl3溶液能够发生显色反应;共有19(不考虑立体异构)种.
的同系物M比其本身相对分子质量大14,M的同分异构体中能同时满足以下条件:①芳香族化合物,②能发生水解反应,③与FeCl3溶液能够发生显色反应;共有19(不考虑立体异构)种.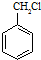 和其他无机物合成
和其他无机物合成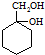 最合理的方案.
最合理的方案. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
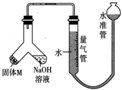 某课外兴趣小组为探究某种铝合金(合金元素为Mg、Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计如图所示装置进行实验.
某课外兴趣小组为探究某种铝合金(合金元素为Mg、Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计如图所示装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| PH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5 | B. | 4 | C. | 3 | D. | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
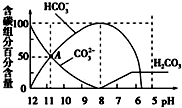
| A. | 0.1 mol/L Na2CO3溶液中c(Na+)+c(H+)═2c(CO32-)+c(HCO3-)+c(OH-) | |
| B. | 当加入20 mL盐酸时,混合溶液的pH约为8 | |
| C. | 常温下CO2饱和溶液的pH约为5.6 | |
| D. | 在A点:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com