

分析 混有硫酸钠、碳酸氢铵的氯化钠固体,由流程可知,①中发生加热条件下分解反应,分解后的固体溶于水后,与氯化钡反应除去硫酸根离子,再利用碳酸钠除去过量的钡离子,过滤后滤液中含NaCl、碳酸钠,加盐酸除去碳酸钠后溶质为NaCl,蒸发得到纯净的NaCl,以此来解答.
解答 解:混有硫酸钠、碳酸氢铵的氯化钠固体,由流程可知,①中发生加热条件下分解反应,分解后的固体溶于水后,与氯化钡反应除去硫酸根离子,再利用碳酸钠除去过量的钡离子,过滤后滤液中含NaCl、碳酸钠,加盐酸除去碳酸钠后溶质为NaCl,蒸发得到纯净的NaCl,
(1)操作①为加热,盛放药品可选用坩埚,故答案为:坩埚;
(2)用硝酸钡溶液会引入杂质硝酸根离子,难以除去,故答案为:会引入杂质硝酸根离子;
(3)进行操作③后,判断溶液中SO42-已除尽的方法为取③反应后的上层清液再滴加氯化钡,若不生成沉淀,可除尽,
故答案为:用干净试管取上层清液少许于试管中,向此试管中滴加BaCl2溶液,若无沉淀,说明SO42-已除尽;
(4)操作③发生反应的化学方程式为BaCl2+Na2CO3═BaCO3↓+2NaCl,其目的为除去过量的钡离子,不先过滤,后加碳酸钠溶液可减少过滤操作次数,
故答案为:除去过量的钡离子;减少过滤操作次数;
(5)由上述分析可知,此设计方案不严密之处及正确的方法为在操作③时加入的Na2CO3溶液煮沸并不能除去,因此在操作④之后应加过量盐酸以除去Na2CO3,然后再加热煮沸除去HCl和CO2,
故答案为:在操作③时加入的Na2CO3溶液煮沸并不能除去;在操作④之后应加过量盐酸以除去Na2CO3,然后再加热煮沸除去HCl和CO2.
点评 本题考查混合物分离提纯实验,为高频考点,把握流程中的化学反应及混合物分离方法为解答的关键,侧重分析与实验能力、推断能力的考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
| A. | 平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L | |
| B. | 反应开始时,丙中的反应速率最快,甲中的反应速率最慢 | |
| C. | 平衡时,乙中CO2的转化率大于60% | |
| D. | 平衡时,甲中和丙中H2的转化率均是60% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如果烧杯中最初装入的是500mL 2mol•L-1的稀硫酸溶液,构成铜锌原电池(见图,假设产生的气体没有损失),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度分别为(溶液体积变化忽略不计)c(H2SO4)=1mol•L-1,c(ZnSO4)=1mol•L-1.
如果烧杯中最初装入的是500mL 2mol•L-1的稀硫酸溶液,构成铜锌原电池(见图,假设产生的气体没有损失),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度分别为(溶液体积变化忽略不计)c(H2SO4)=1mol•L-1,c(ZnSO4)=1mol•L-1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二个 | B. | 三个 | C. | 四个 | D. | 五个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硝酸反应:Fe+4H++NO3-=Fe3++NO↑+2H2O | |
| B. | 磁性氧化铁与浓盐酸反应:Fe3O4+8H+=Fe2++2Fe3++4H2O | |
| C. | 氢氧化铁与氢碘酸反应:Fe(OH)3+3H+=Fe3++3H2O | |
| D. | 溴化亚铁溶液与足量氯水反应:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与28gCO具有相同分子数的CO2的质量一定是44g | |
| B. | 在标准状况下,11.2L某气体的质量为22g,则该气体的相对分子质量是44g/mol | |
| C. | 16gO2和16gO3含的氧原子个数一样多 | |
| D. | 1L1mol•L-1Fe(OH)3胶体中胶体微粒数目等于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
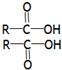 $→_{△}^{浓H_{2}SO4}$
$→_{△}^{浓H_{2}SO4}$


 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O
+H2O
 +4NaOH$\stackrel{△}{→}$
+4NaOH$\stackrel{△}{→}$ +CH3COONa+4H2O+4CH3CH2CH2CH2OH.
+CH3COONa+4H2O+4CH3CH2CH2CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某物质在固态时能导电,可确认该物质是金属单质 | |
| B. | 一种元素在同一物质中可显示不同价态,但一定是该元素的相邻价态 | |
| C. | 氧化物只可能是氧化产物,不可能是还原产物 | |
| D. | 有的无机化学反应不属于化合、分解、置换、复分解中的任何一种反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com