
分析 (1)含有弱酸HA和其钠盐NaA的混合溶液,向其中加入少量酸或碱时,溶液的酸碱性变化不大,是由于加入酸时生成弱电解质,加入碱时生成正盐,溶液中氢离子或氢氧根离子浓度变化不大而起到缓冲作用;
(2)①从溶液电中性的角度比较离子浓度大小;根据物料守恒和电荷守恒分析;
②若HA为CH3COOH,该溶液显酸性,说明c(H+)>c(OH-),结合溶液电中性原则分析;溶液中溶质为等浓度的醋酸和醋酸钠.
解答 解:(1)含有弱酸HA和其钠盐NaA的混合溶液,向其中加入少量酸或碱时,溶液的酸碱性变化不大,是由于加入酸时发生:A-+H+?HA,加入碱时发生:HA+OH-?H2O+A-,溶液中氢离子或氢氧根离子浓度变化不大而起到缓冲作用,
故答案为:A-+H+?HA;HA+OH-?H2O+A-;
(2)①该溶液显碱性,则c(H+)<c(OH-),根据溶液电中性原则可知c(Na+)+c(H+)=C(CN-)+c(OH-),溶液中物料守恒为2c(Na+)=c(CN-)+c(HCN),则c(Na+)>c(CN-),则质子守恒为c(OH-)=c(H+)+$\frac{1}{2}$c(HCN)-$\frac{1}{2}$c(CN-);
故答案为:>;因为c(Na+)+c(H+)=C(CN-)+c(OH-),溶液显碱性,则c(H+)<c(OH-),所以c(Na+)>c(CN-);c(OH-)=c(H+)+$\frac{1}{2}$c(HCN)-$\frac{1}{2}$c(CN-);
②若HA为CH3COOH,该溶液显酸性,说明c(H+)>c(OH-),根据溶液电中性原则可知c(CH3COO-)>c(Na+),溶液中溶质为等浓度的醋酸和醋酸钠,则物料守恒为2c(Na+)=c(CH3COO-)+c(CH3COOH),
故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
点评 本题考查了酸碱混合的定性判断、溶液中离子浓度定性比较及溶液中守恒关系的应用等知识,题目难度中等,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 89.6mL | B. | 112mL | C. | 224mL | D. | 672mL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
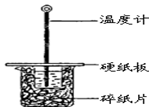 某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图1所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.
某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图1所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.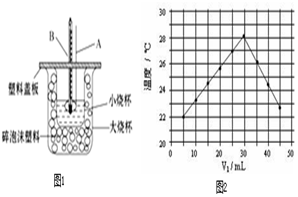
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com