
| ||
科目:高中化学 来源: 题型:
| A、光导纤维、棉花、油脂、ABS树脂都是由高分子化合物组成的物质 |
| B、开发核能、太阳能等新能源,推广基础甲醇汽油、使用无磷洗涤剂都可直接降低碳排放 |
| C、红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析 |
| D、通电时,溶液中的溶质离子分别向两极移动,胶体中的分散质粒子向某一极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 微粒组 | 所加试剂 | 离子方程式 |
| A | NH4+、Mg2+、SO42- | 少量Ba(OH)2溶液 | NH4++SO42-+Ba2++OH- =BaSO4↓+NH3?H2O |
| B | Mg2+、HCO3-、Cl- | 过量NaOH溶液 | Mg2++2HCO3-+4OH- =Mg(OH)2↓+2CO32-+2H2O |
| C | Ca2+、NO3-、HCO3- | NaHSO4溶液 | HCO3-+H+=CO2↑+H2O |
| D | K+、NH3?H2O、CO32- | 通入过量CO2 | NH3?H2O+CO2=NH4++HCO3- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(NH4+)相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2SO4]<c[(NH4)2Fe(SO4)2]<c(NH4Cl) |
| B、中和相同体积、相同pH的①硫酸、②盐酸和③醋酸所需相同浓度的NaOH溶液的体积关系:V1>V2=V3 |
| C、0.2 mol?L-1 HCl溶液与等体积0.05 mol?L-1 Ba(OH)2溶液混合后,溶液的pH=1 |
| D、已知难溶物FeS的Ksp=8.1×10-17,FeS饱和溶液中c(H+)2?c(S2-)=1.0×10-22,为使溶液里c(Fe2+)达到了1mol?L-1,应调节溶液中的c(H+)为1.11×10-3mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
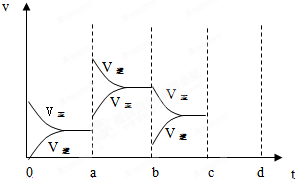
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在蒸发皿中放入NaCl溶液,加热、蒸发制取NaCl晶体 |
| B、用10ml的量筒量取5.2ml的盐酸 |
| C、用托盘天平称取25.2gNaCl |
| D、用50ml容量瓶配制100ml 0.1mol/L的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 有关问题 |
| ①计算所需KCl的质量 | 需要称量KCl的质量为 |
| ②称量KCl固体 | 称量需要用到的主要仪器是: |
| ③将KCl加入100ml烧杯中,并加入适量水 | |
| ④将烧杯中溶液转移至500ml容量瓶中 | |
| ⑤向容量瓶中加蒸馏水至刻度线 | 在进行此操作时当加水至刻度线1-2cm处应如何操作: |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
2- 4 |
| 实验序号 | 硫酸体积 | NaOH溶液体积 | NaOH溶液浓度 |
| ① | 5.00mL | 35.65mL | 5.00mol?L-1 |
| ② | 5.00mL | 39.65mL | 5.00mol?L-1 |
| ③ | 5.00mL | 35.55mL | 5.00mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、.金属钠与氧气反应,条件不同产物不同 |
| B、钠着火时可用水扑灭 |
| C、将钠保存在汽油中 |
| D、金属钠的化学性质活泼,可从硫酸铜溶液中置换出金属铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com