
室温时,下列各组离子在指定溶液中可以大量共存的是
A.由水电离出的c(H+)=10 -12 mol·L-1的溶液中:
-12 mol·L-1的溶液中:
N a+、Ba2+、HCO
a+、Ba2+、HCO 、Cl-
、Cl-
B.无色透明溶液中:K+、Cu2+、SO 、Na+
、Na+
C.含有大量AlO 的溶液中:Na+、OH-、Cl-、CO
的溶液中:Na+、OH-、Cl-、CO
D.能使pH试纸显红色的溶液中:Na+、ClO-、Fe2+、SO
科目:高中化学 来源: 题型:
可逆反应:2SO2+O2 2SO3的平衡状态下,保持恒温恒容向容器中加入一定量的O2,下列说法正确的是(K为平衡常数,Qc为浓度商)( )
2SO3的平衡状态下,保持恒温恒容向容器中加入一定量的O2,下列说法正确的是(K为平衡常数,Qc为浓度商)( )
A.Qc不变,K变大,O2转化率增大
B.Qc不变,K变大,SO2转化率减小
C.Qc变小,K不变,O2转化率减小
D.Qc增大,K不变,SO2转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
某物质A加热分解,产物都是气体,化学方程式为2A B+2C+2D。测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为 ( )
B+2C+2D。测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为 ( )
A.7d B.5d C.2.5d D.2d
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验所推出的结论不正确的是( )
A.向漂白粉中加入稀盐酸,有无色无味气体产生,则说明漂白粉已变质
B.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
C.溶液里加入盐酸,有能使澄清石灰水变浑浊的无色无味的气体生成,则说明溶液中一定含有HCO3-
D.溶液中加入稀硝酸后,再加少量AgNO3溶液,有白色沉淀生成,则溶液中含有Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
现用18.4 mol·L-1的浓硫酸来配制500mL 0.2 mol·L-1的稀硫酸,可供选择的仪器有:①玻璃棒 ②烧杯 ③胶头滴管 ④量筒 ⑤托盘天平
(1)上述仪器在配制过程中不需要用到的是__________________。(填序号)除上述仪器外,尚缺最重要的仪器是 。
(2)计算所需浓硫酸的体积为___________m L(保留1位小数)。
(3)实验中用到玻璃棒,其作用分别是:___________、__________。
(4)配制时,一般可分为以下几个步骤:
①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却。其正确的操作顺序
为:②→①→③→____ →____→____→____→④(填序号)
(5)在配制过程中,下列操作可引起所配溶液浓度偏低的有____________(填序号)
①定容时,仰视刻度线。
②未冷却至室温就转移到容量瓶中。
③容量瓶中含有少量蒸馏水。
④未洗涤稀释浓硫酸时用过的烧杯和玻璃棒。
⑤定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线。
查看答案和解析>>
科目:高中化学 来源: 题型:
在无色透明的强酸性溶液中,能大量共存的是
A.Na+、NO 、Al3+、Cl-
、Al3+、Cl-
B.Na+、CO 、K+、NO
、K+、NO
C.Cu2+、K+、SO 、Cl-
、Cl-
D.Ba2+、K+、Cl-、CO
查看答案和解析>>
科目:高中化学 来源: 题型:
在一瓶pH=1的无色溶液中,已检验出含有Ba2+、Ag+,则下列粒子:①Cl-、②Mg2+、③Cu2+、④NO 、⑤AlO
、⑤AlO 、⑥CO
、⑥CO 、⑦NH3·H2O,在此溶液中不能大量存在的正确组合是
、⑦NH3·H2O,在此溶液中不能大量存在的正确组合是
A.①②③⑥⑦ B.②③⑤⑥⑦
C.①③⑤⑥⑦ D.①②⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家最近在-100 ℃的低温下合成了一种烃X,经红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,根据分析,绘制了如图所示的球棍模型。下列说法中错误的是( )
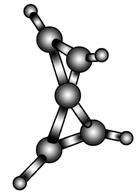
A.烃X的分子式为C5H4
B.分子中碳原子的化学环境有2种
C.具有2个三元环的X的同分异构体的种类共2种(含本身)
D.X分子中只有C—C单键,没有C===C双键
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
[实验一] 配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol/L的醋酸溶液,用0.2 mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题。
(1)配制250 mL 0.2 mol/L醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、________和________。
(2)为标定某醋酸溶液的准确浓度,用0.200 0 mol/L的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
则该醋酸溶液的准确浓度为________(保留小数点后四位)。
[实验二] 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋 酸的pH,结果如下:
酸的pH,结果如下:
| 醋酸浓度(mol/L) | 0.001 0 | 0.010 0 | 0.020 0 | 0.100 0 | 0.200 0 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
回答下列问题:
(1)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是:________________________________________________________________________
________________________________________________________________________。
(2)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度将________(填“增大”、“减小”或“不变”)。
[实验三] 探究温度对醋酸电离程度的影响
请你设计一个实验完成该探究,请简述你的实验方案:
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com