
【题目】将一定浓度的稀氢氧化钠溶液滴加到等浓度的醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,一定错误的是( )
A.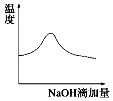
B.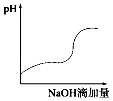
C.
D.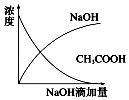
科目:高中化学 来源: 题型:
【题目】甲、乙是周期表中同一主族的两种元素,若甲的原子序数为 x,则乙的原子序数不可能为( )
①x+2 ②x+4 ③x+16 ④x+26 ⑤x+32
A.①⑤B.②C.③D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要意义.
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等. 已知①Fe2O3(s)+3C(石墨,s)=2Fe(s)+3CO(g)△H1=+489.0kJmol﹣1
②C(石墨,s)+CO2(g)=2CO(g)△H2=+172.5kJmol﹣1
则CO气体还原Fe2O3(s)的热化学方程式为 .
(2)将CO2转化为甲醇的热化学方程式为CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H<0.850℃时, 该反应的平衡常数K=1.
①该反应的平衡常数表达式为 .
②若反应的容器容积为2.0L,反应进行4.0min时,容器内气体的物质的量减少了0,8mol,这段时间内υ(CO2)= .
③850℃时,若向1.0L的密闭容器中同时充入3.0molCO2(g)、1.0mol H2(g)、1.0mol CH3OH(g)和
5.0mol H2O(g),上述反应向(填“正反应”或“逆反应”)方向进行.
④若上述反应的平衡常数K值增大,该反应(填序号).
a.一定下正反应方向移动 b.一定下逆反应方向移动
c.在平衡移动过程中正反应速率先增大后减小 d.在平衡移动过程中逆反应速率先减小后增大.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )
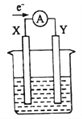
A. 外电路的电流方向为:X→外电路→Y
B. 若两电极分别为Zn和石墨棒,则X为石墨棒,Y为Zn
C. SO42-移向X电极,Y电极上有氢气产生
D. X极上发生的是还原反应,Y极上发生的是氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑨九种元素,填写下列空白:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1)在这些元素中,化学性质最不活泼的是______(填元素符号),②位于元素周期表的第____纵行。
(2)这些元素的最高价氧化物的水化物中,碱性最强的化合物的电子式是___________。
(3)④的单质比⑨的单质熔点_______(填“高”或“低”),④⑤⑥⑦的简单离子半径由小到大的顺序为___________________(用序号表示)。
(4)①与⑦形成的某种化合物经常用作萃取剂,其结构式为________,该化合物属于________(填“共价”或“离子”)化合物。④与③形成的淡黄色的固体的阴、阳离子的个数比为_______。
(5)元素③与元素⑥相比,能证明这两种元素非金属性强弱的事实是_______(填选项序号)。
A.常温下③的单质和⑥的单质状态不同 B.③的简单氢化物比⑥的简单氢化物稳定
C.简单氢化物的沸点:③>⑥ D.③的单质能与⑥的简单氢化物反应生成⑥的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 某实验小组对H2O2的分解做了如下探究。下表是研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 mL5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5 min |
块状 | 微热 | 反应较慢,火星红亮,但木条未复燃 | 30 min |
(1)该反应是_________反应(填“放热”或“吸热”)。
(2)实验结果表明,催化剂的催化效果与_____________有关。
Ⅱ.某可逆反应在体积为5 L的密闭容器中进行,0~3分钟内各物质的物质的量变化情况如图所示(A、B、C均为气体)。
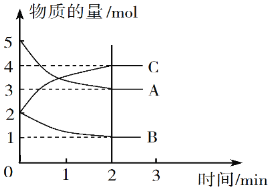
(3)该反应的化学方程式为_____________。
(4)反应开始至2分钟时,B的平均反应速率为__________。
(5)能说明该反应已达到平衡状态的是_________(填字母)。
A.v(A)= 2v(B) B.容器内压强保持不变
C.v逆(A)= v正(C) D.容器内混合气体的密度保持不变
Ⅲ.已知:断开1 mol共价键吸收的能量或形成1 mol共价键释放的能量数据如下表:
共价键 | H—H | N—H | N≡N |
能量变化/kJ·mol1 | 436 | 390.8 | 946 |
(6)已知合成氨反应:N2(g)+3H2(g)![]() 2NH3(g),则N2(g)与H2(g)反应有2 mol NH3(g)生成时,能量的变化情况是_________(填“吸收”或“放出”以及具体数值)kJ。
2NH3(g),则N2(g)与H2(g)反应有2 mol NH3(g)生成时,能量的变化情况是_________(填“吸收”或“放出”以及具体数值)kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上从电解精炼铜的阳极泥(成分为CuS、Cu2Se、Cu2Te 和少量金属单质Au) 中回收碲、硒的工艺流程如下:
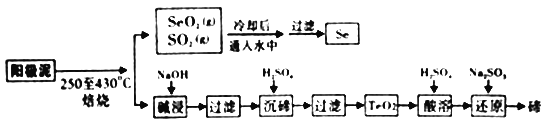
已知: (1)TeO2是两性氧化物。
(2)Se和TeO2的物理性质如下:
物理性质 | 熔点 | 沸点 | 水溶性 |
Se | 221℃ | 685℃ | 难溶于水 |
TeO2 | 733℃ | 1260℃ | 微溶于水 |
(1)“培烧”时,为提高原料的利用率,可采取的措施有_________(写一条即可)。
(2)“碱浸”过滤得到滤渣的主要成分是_______(填化学式)。
(3)“沉碲”时控制溶液的pH为4.5-5.0,生成TeO2沉淀。如果H2SO4的浓度过大,将导致“沉碲”不完全,原因为______________。
(4)“酸溶”将TeO2先溶于硫酸得到Te(SO4)2,然后加入Na2SO3溶液进行还原,还原碲的离子反应方程式是______________。
(5)SeO2与SO2的混合烟气可用水吸收制得单质Se,当有10mol电子转移时,会生成______mol Se。过滤所得粗硒可采用真空蒸馏的方法提纯获得纯硒,采用真空蒸馏的目的是_______________。
(6)常温下,SeO2与NaOH溶液反应所得NaHSeO3溶液的pH______7(填“>”“<”或“=”),理由是_______________。(已知25℃时,亚硒酸(HSeO3)的Ka1=2.5×10-3,Ka2=2.6×10-7)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示三个烧瓶中分别装人含酚酞的0.01mol/LCH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质.则下列叙述正确的是( ) 
A.①说明水解反应为放热反应
B.③说明水解反应为吸热反应
C.①中溶液红色变浅
D.③中溶液红色变深
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com