
| A. | 只显红色 | B. | 呈无色 | C. | 无色或蓝色 | D. | 红色或无色 |
分析 根据两种溶液中H+和OH-的关系以及氨水为弱电解质的性质,判断反应后酸碱的过量,进而判断反应后溶液的酸碱性,结合酚酞的变色范围为8-10解答该题.
解答 解:pH=3的盐酸中c(H+)=10-3mol/L,pH=11的氨水中c(OH-)=10-3mol/L,两种溶液H+与OH-离子浓度相等,但由于氨水为弱电解质,不能完全电离,则氨水浓度大于盐酸浓度,反应后氨水过量,溶液呈碱性,则所得溶液的pH>7,滴加酚酞,如pH<8,则呈无色,如pH>8,则呈红色,
故选D.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重于学生的分析能力的考查,明确混合溶液中的溶质及其性质是解本题关键,注意把握酚酞的变色范围,题目难度不大.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:实验题
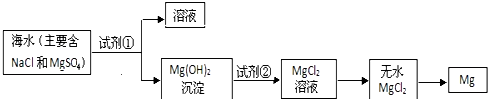
| 学生观点 | 是否正确 | 简述理由 |
| 观点 1 | 否 | 海水中镁离子浓度小,沉淀剂的用量大,不利于镁离子的沉淀 |
| 观点 2 | 否 | 能源消耗大,海水的综合利用低,成本高 |
| 观点 3 | 是 | 镁离子富集浓度高,成本低 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
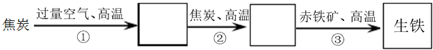
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z的物质的量之比为1:3:2 | |
| B. | 容器内的压强不再随时间变化 | |
| C. | 单位时间内每消耗1molX,同时消耗3molY | |
| D. | 混合气体的密度不再随时间变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成2mol H2的同时消耗了1mol CO | |
| B. | c(CO):c(CH3OH)=1:1 | |
| C. | 在恒温恒容的容器中,混合气体的压强保持不变 | |
| D. | 在绝热恒容的容器中,反应的平衡常数不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
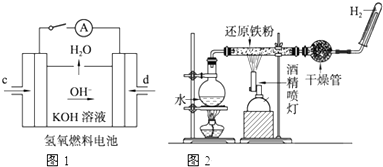
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
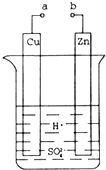 原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置.
原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com