
| A. | CH4 | B. | CO2 | C. | NaHCO3 | D. | CH3COOH |
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.0800 | B. | 0.1200 | C. | 0.1600 | D. | 0.2400 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe溶于稀盐酸:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 用小苏打治疗胃酸过多:CO32-+2H+═CO2↑+H2O | |
| C. | 用FeCl3溶液腐蚀印刷电路板上铜箔:Fe3++Cu═Fe2++Cu2+ | |
| D. | 铝与浓氢氧化钠溶液反应:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
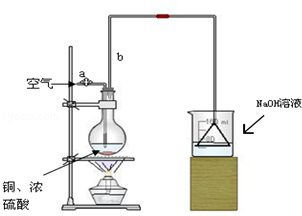 某学校课外活动小组针对教材中铜与浓硫酸反应,提出了“能够与铜反应的硫酸的最低浓度是多少?”的探究课题,并设计了如下方案进行实验:实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液.
某学校课外活动小组针对教材中铜与浓硫酸反应,提出了“能够与铜反应的硫酸的最低浓度是多少?”的探究课题,并设计了如下方案进行实验:实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com