
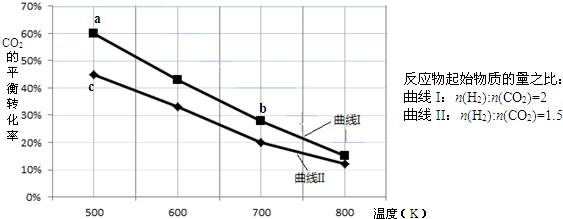
| A、该反应的△H>0 |
| B、达平衡时,v(H2)正=v(CO2)逆 |
| C、b点对应的平衡常数K值大于c点 |
| D、a点对应的H2的平衡转化率为90% |
| 1.8 |
| 2 |
| 1.8 |
| 2 |


科目:高中化学 来源: 题型:
| A、只有①正确 | B、③④ |
| C、只有③ | D、①②③④都正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、汽油中加入乙醇 |
| B、乙醇的燃烧 |
| C、蔗糖的发酵 |
| D、甜菜的生长 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HClO的结构式:H-Cl-O |
B、Na2O2的电子式: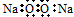 |
C、CO2的比例模型: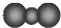 |
| D、Na原子外围电子排布式:3s1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、检验甲酸中是否混有甲醛,可向样品中加入足量NaOH溶液以中和HCOOH,再做银镜反应实验 |
| B、实验室制取乙酸乙酯时,将反应产生的蒸气经导管通入到饱和烧碱溶液中 |
| C、液态溴乙烷中加入AgNO3溶液观察有无淡黄色沉淀生成,以检验溴元素的存在 |
| D、实验室制硝基苯要在水浴的热水中插入温度计 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一种单核阳离子和一种多核阳离子 |
| B、一种单质和一种化合物分子 |
| C、一种分子和一种离子 |
| D、一种原子和一种分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1:1 |
| B、3:2:1 |
| C、6:3:2 |
| D、1:2:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com