
| A. |  根据图可判断可逆反应A2(g)+3B2(g)?2AB3(g),正反应是吸热反应 | |
| B. | 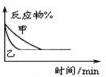 如图表示压强对反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 | |
| C. | 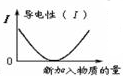 图可表示乙酸溶液中通入氨气至过量的过程中溶液导电性的变化 | |
| D. | 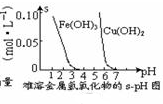 根据图可知,若除去CuSO4溶液中的Fe3+,可向溶液中加入CuO,调节pH在4~5之间即可 |
分析 A、从温度升高正逆反应速率的变化判断平衡移动的方向,以此来判断反应热问题;
B、从压强对反应速率的影响结合图象中曲线斜率的大小判断压强大小,根据压强对平衡移动的影响判断反应物含量的变化;
C、从溶液中离子浓度的变化判断导电性问题;
D、根据两种物质完全沉淀时的溶液PH大小来分析.
解答 解:A、根据图象可知,温度升高,逆反应速率大于正反应速率,平衡向逆反应方向移动,则正反应为放热反应,△H<0,故A错误;
B、从图象可知,乙曲线斜率大,乙反应到达平衡用得时间少,则乙反应速率快,根据压强对反应速率的影响,压强越大反应速率越大,则乙曲线压强大,根据反应方程式可以看出,物质D为固体,则增大压强平衡向正反应方向移动,反应物的含量减小,而图中达到平衡时反应物的浓度在两种不同压强下相同,是不符合实际的,故B错误;
C、乙酸和氨水都为弱电解质,二者反应生成醋酸铵为强电解质,溶液中离子浓度增大,导电性增强,故C错误;
D、CuSO4溶液中加入适量CuO,发生:CuO+2H+═Cu2++H2O,溶液中H+浓度减小,易于Fe3+水解生成沉淀,当调节pH在4左右时,Fe3+全部水解生成沉淀而除去,故D正确.
故选D.
点评 本题为图象题,主要是影响反应速率、化学平衡因素、混合物分离方法、弱电解质导电性分析,做题时注意分析图象题中曲线的变化特点是做该类题型的关键,本题难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 按要求完成下列问题:
按要求完成下列问题: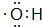 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H20分子中只含有非极性共价键 | |
| B. | H20分子中只含有极性共价键 | |
| C. | 水分子间只存在氢键 | |
| D. | 冷却反应堆用水在地球上常温下是固态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/K | 298 | 398 |
| 平衡常数K | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 符合通式CnH2nO3 | B. | 和乙醇中化学键类型相同 | ||
| C. | 能和金属钠反应 | D. | 能使酸性KMnO4溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com