
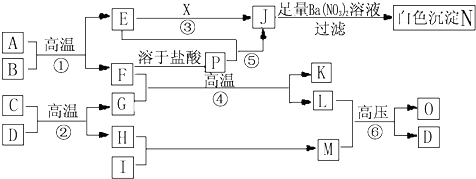
| ||
| 0.5mol |
| 2mol |
| 0.5×28+0.5×2+1.5×18 |
| 0.5+0.5+1.5 |
| ||
| ||
| ||
| ||
| ||
| 1165g |
| 233g/mol |
| ||
| ||


科目:高中化学 来源: 题型:
| A、第二周期,ⅢA族 |
| B、第二周期,ⅦA族 |
| C、第五周期,ⅡA族 |
| D、第七周期,ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离核较近区域运动的电子能量较高 |
| B、M层最多容纳的电子数不超过8 |
| C、K层为最外电子层时最多只能容纳8个电子 |
| D、稀有气体元素的原子形成了稳定的电子层结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油的分馏和裂化均属于化学变化 |
| B、乙醇、乙酸能用碳酸钠溶液、紫色石蕊溶液、酸性高锰酸钾溶液等多种方法鉴别 |
| C、油脂、塑料、天然橡胶都是高分子化合物 |
| D、因为葡萄糖在糖类结构中最简单,因此它是一种单糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:
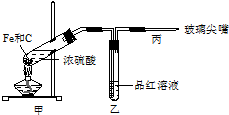 (1)下列仪器在使用前必须检查其是否漏水的是
(1)下列仪器在使用前必须检查其是否漏水的是查看答案和解析>>
科目:高中化学 来源: 题型:
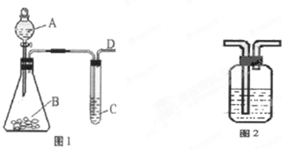 某同学用如图1所示的装置来探究SO2的性质及有关实验.
某同学用如图1所示的装置来探究SO2的性质及有关实验.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②⑤⑥ | B、①③⑥ |
| C、②④⑤ | D、①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③④ | B、①③④ |
| C、②③④ | D、③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com