
| A. | NH4+、Br-、CO32- | B. | NH4+、I-、SO32- | C. | Fe2+、I-、SO32- | D. | Fe2+、Br-、CO32- |
分析 ①在原溶液中滴加足量的饱和氯水后,有气泡生成,说明溶液中含有CO32-,则一定不存在Fe2+,溶液呈橙黄色,说明可能生成I2或Br2;
②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成,说明不含SO32-;
③橙黄色溶液不能使淀粉溶液变蓝色,说明不含I-,则一定含有Br-,以此来解答.
解答 解:①在原溶液中滴加足量的饱和氯水后,有气泡生成,说明溶液中含有CO32-,则一定不存在Fe2+,溶液呈橙黄色,说明可能生成I2或Br2;
②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成,说明不含SO32-;
③橙黄色溶液不能使淀粉溶液变蓝色,说明不含I-,
综上所述,溶液中一定不存在:Fe2+、I-、SO32-,一定存在Br-、CO32-,由于没有涉及到NH4+离子的性质,则NH4+不能确定是否存在,
故选C.
点评 本题考查离子的检验,为高频考点,明确常见离子的性质为解答关键,注意通过反应的现象结合离子的性质进行推断,要排除实验操作的干扰,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
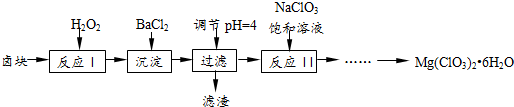
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑦ | B. | ②④⑥ | C. | ②③⑦ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素原子第一电离能大小关系:Z>Y>W>X>M | |
| B. | XZ2、X2M2、W2Z2均为直线形的共价化合物 | |
| C. | Y与M形成化合物键长大于Z与M形成化合物的键长 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com