
NA代表阿伏加德罗常数,下列说法正确的是
A.在同温同压时,相同体积的任何气体单质所含的原子数相同
B.2 g H2所含的原子数目为NA
C.在常温常压下,11.2 L N2所含的原子数为NA
D.17 g NH3所含氢原子数目为3NA
科目:高中化学 来源: 题型:
下表是元素周期表的短周期部分,表中字母分别表示一种元素。
| a | |||||||
| d | f | g | |||||
| b | c | e | h |
请回答下列问题:
(1)g与a可形成化合物a2g,试写出它的结构式 。
(2)d、f、h 三种元素最高价氧化物对应的水化物的酸性由弱到强的顺序为(用化学式表示) 。
(3)在1L的密闭容器中,通入1mol f2气体和3mol a2气体,一定温度下反应生成fa3气体,2 min时,测得f2的浓度为0.75mol·L-1,则2 min时fa3的物质的量为 mol ,a2的平均反应速率v(a2)= mol·(L·min) -1。
(4)a、d两种元素可形成多种化合物,其中化合物X的产量是衡量一个国家石油化工发展水平的标志。X可与H2O在一定条件下反应生成化合物乙醇,该反应的化学方程式为: 。
(5)1g甲烷完全燃烧生成液态水,放出56kJ的热量,请写出热化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)电镀是将镀件与电源的 极连接。
(2)化学镀的原理是利用化学反应生成金属单质沉淀在镀件表面形成的镀层。
①若用铜盐进行化学镀铜,应选用 (填“氧化剂”或“还原剂”)与之反应。
②某化学镀铜的反应速率随镀液pH变化如右图所示。该镀铜过程中,镀液pH控制在12.5左右。据图中信息,给出使反应停止的方法: 。
(3)酸浸法制取硫酸铜的流程示意图如下:

①步骤(i)中Cu2(OH)2CO3发生反应的化学方程式为 。
②步骤(ii)所加试剂起调节pH作用的离子是 (填离子符号)。
③在步骤(iii)发生的反应中,1molMnO2转移2 mol电子,该反应的离子方程式为:
。
④步骤(iv)除去杂质的化学方程式可表示为
3Fe3++NH4++2SO42-+6H2O=NH4Fe3(SO4)2(OH)6↓+6H+,过滤后母液的pH=2.0,
c( )=a mol·L—1,c(
)=a mol·L—1,c( )=b mol·L—1,c(
)=b mol·L—1,c( )=d mol·L—1,
)=d mol·L—1,
该反应的平衡常数K= (用含a、b、d的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E、F、W都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素。A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子,W的+1价阳离子正好充满K,L,M三个电子层。回答下列问题:
(1)A、B、C、D、E、F、W几种元素中第一电离能最小的是___________ (填元素符号),D元素的原子核外有
种不同运动状态的电子;有 种不同能级的电子。基态的F3+核外电子排布式是 。
(2)B的气态氢化物在水中的溶解度远大于A、C的气态氢化物,原因是 。
(3)化合物ECAB中的阴离子与AC2互为等电子体,该阴离子的电子式是 。
 (4)FD3与ECAB溶液混合,得到含多种配合物的血红色溶液,其中配位数为5的配合物的化学式是 。
(4)FD3与ECAB溶液混合,得到含多种配合物的血红色溶液,其中配位数为5的配合物的化学式是 。
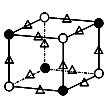
 (5)化合物EF[F(AB)6]是一种蓝色晶体,右图表示其晶胞的
(5)化合物EF[F(AB)6]是一种蓝色晶体,右图表示其晶胞的
 (E+未画出)。该蓝色晶体的一个晶胞中E+的个数为 。
(E+未画出)。该蓝色晶体的一个晶胞中E+的个数为 。
(6)W的二价阳离子能与乙二胺(H2N—CH2一CH2一NH2)形成配
离子如右图所示,该配离子中含有的化学键类型有 。(填字母)
a.配位键 b.极性键 c.离子键 d.非极性键
阴离子CAB-中的A原子与乙二胺(H2N—CH2一CH2一NH2)中C原子的杂化方式为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关0.2 mol·L-1 BaCl2溶液的说法中,不正确的是
A.500 mL溶液中Cl-浓度为0.2 mol·L-1
B.500 mL溶液中Ba2+浓度为0.2 mol·L-1
C.500 mL溶液中Cl-总数为0.2 NA
D.500 mL溶液中Ba2+和Cl-总数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
向一定量的饱和NaOH溶液中加入少量Na2O2固体,恢复到原来温度时,下列说法中正确的是
A.溶液中的Na+总数增大 B.溶液的碱性增强
C.溶质的质量分数不变 D.溶液的质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是 ( )
A.碳的摩尔质量为12g
B.1mol NaCl的质量是58.5g/mol
C.58.5g NaCl所含Na+和Cl-共1mol
D.1mol NaCl约含6.02×1023个Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
现有0.2mol/L Ba(NO3)2溶液,则2L该溶液中含有________mol Ba2+;3L该溶
液中含有________mol NO3-;0.5L该溶液中NO3-的物质的量浓度为________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是________;

(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为____________________;
(3)Se原子序数为________,其核外M层电子的排布式为________;
(4)H2Se的酸性比H2S________(填“强”或“弱”)。气态SeO3分子的立体构型为________,SO 离子的立体构型为________;
离子的立体构型为________;
(5)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:________;
②H2SeO4比H2SeO3酸性强的原因:_______________________
__________________________________________________________;
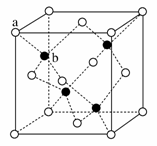
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0 pm,密度为________g·cm-3(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为________pm(列式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com