
【题目】现有含少量NaCl、Na2SO4、Na2CO3等杂质的NaNO3溶液,用适当的试剂除去杂质,得到纯净的NaNO3固体的实验流程如图所示。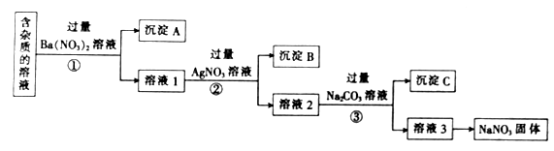
(1)沉淀A的主要成分是(填化学式)。
(2)②中反应的化学方程式是。
(3)①②③中均进行的分离操作是。
(4)实验室用上述实验获得的NaNO3固体配制480 mL 0.40 mol.L-1NaNO3溶液。
①配制溶液前要先计算,需称取NaNO3固体g。
②某同学转移溶液的操作如图所示,图中仪器的名称是烧杯和,该同学操作中的错误是。
③若用胶头滴管定容时,不小心加水超过了刻度线,则应该采取的处理方法是。
④下列操作中,可能造成所配制溶液的浓度偏低的是(填字母)。
a.没有洗涤烧杯和玻璃棒
b.定容时,俯视刻度线
c.洗涤后的容量瓶中残留少量蒸馏水
【答案】
(1)BaSO4、BaCO3
(2)AgNO3+NaCl=AgCl↓+NaNO3
(3)过滤
(4)17.0,500mL容量瓶,未用玻璃棒引流,重新配制溶液,a
【解析】(1)硫酸钠、碳酸钠与硝酸钡均反应生成沉淀,则沉淀A的主要成分是BaSO4、BaCO3。
(2)溶液1中含有氯化钠、过量的硝酸钡,加入硝酸银溶液产生氯化银沉淀,则②中反应的化学方程式是AgNO3+NaCl=AgCl↓+NaNO3。
(3)①②③中均进行的分离操作是固液分离,属于过滤操作。
(4)①需要使用500mL容量瓶,则需称取NaNO3固体的质量是0.5L×0.4mol/L×85g/mol=17.0g。②图中仪器的名称是烧杯和500mL容量瓶,该同学操作中的错误是未用玻璃棒引流。③若用胶头滴管定容时,不小心加水超过了刻度线,实验失败,则应该采取的处理方法是重新配制溶液。④a.没有洗涤烧杯和玻璃棒,溶质减少,浓度偏低;b.定容时,俯视刻度线,溶液体积减少,浓度偏高;c.洗涤后的容量瓶中残留少量蒸馏水不影响,答案选a。
【考点精析】根据题目的已知条件,利用配制一定物质的量浓度的溶液的相关知识可以得到问题的答案,需要掌握配制物质的量浓度溶液时,先用烧杯加蒸馏水至容量瓶刻度线1cm~2cm后,再改用交投滴管加水至刻度线.


科目:高中化学 来源: 题型:
【题目】有机物A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平.C在一定条件下也会生成D,D能使石蕊溶液变红;E是具有果香味的有机物,F是一种高分子化合物,可制成多种包装材料. 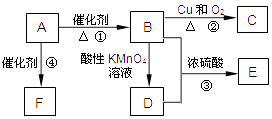
(1)A物质的结构简式为 .
(2)B→C的反应类型:;
(3)反应③的化学方程式为 .
(4)请设计一个简单的实验,以验证C物质存在该官能团的方法 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:
CO(g)+H2O(g) ![]() CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= , 该反应为反应(选填“吸热”、“放热”).
(2)能判断该反应是否达到化学平衡状态的依据是;
A.容器中压强不变
B.混合气体中c(CO)不变
C.v逆(H2)=v正(H2O)
D.c(CO2)=c(CO)
(3)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,在此温度下,若该容器中含有1molCO2、1.2molH2、0.75molCO、1.5molH2O,这状态(是或否)处于平衡状态?若不是,反应向哪个方向进行? . (选填“向正反应方向”、“向逆反应方向”).
(4)若830℃时,向容器中充入lmolCO、5molH2O,反应达到平衡后,CO的转化率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4CO(g)+2NO2(g)N2(g)+4CO2(g)开始进行时,CO的浓度为4mol/L,N2的浓度为0,2min后测得N2的浓度为0.6mol/L,则此段时间内,下列反应速率表示正确的是( )
A.v(CO)=1.2 mol/(Ls)
B.v(NO2)=0.3 mol/(Lmin)
C.v(N2)=0.6 mol/(Lmin)
D.v(CO2)=1.2 mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应N2+3H2═2NH3的能量变化如图所示,E是正值,该反应的热化学方程式是( ) 
A.N2(g)+3H2(g)═2NH3(l);△H=2(a﹣b﹣c)kJ?mol﹣1
B.N2(g)+3H2(g)═2NH3(g);△H=2(b﹣a)kJ?mol﹣1
C.![]() N2(g)+
N2(g)+ ![]() H2(g)═NH3(l);△H=(b+c﹣a)kJ?mol﹣1
H2(g)═NH3(l);△H=(b+c﹣a)kJ?mol﹣1
D.![]() N2(g)+
N2(g)+ ![]() H2(g)═NH3(g);△H=(a+b)kJ?mol﹣1
H2(g)═NH3(g);△H=(a+b)kJ?mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.标况下,22.4L的Cl2与足量水反应中电子转移了2NA
B.0.1mol/LK2SO4溶液中含有0.2NA个阳离子
C.常温常压下,22.4LO2气体的分子数小于NA
D.20g D2O所含的中子数为9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面有关Na2CO3与NaHCO3的性质比较中错误的是( )
A.相同浓度溶液的碱性:Na2CO3>NaHCO3
B.在水中的溶解度:Na2CO3>NaHCO3
C.与同浓度的硫酸反应放出气泡的速率:NaHCO3<Na2CO3
D.热稳定性:NaHCO3<Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列九种物质:
①H2②铝 ③醋酸 ④CO2⑤H2SO4⑥Ba(OH)2固体⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3 ⑩NaHSO4
(1)按物质的分类方法填写表格的空白处:
属于非电解质的是属于弱电解质的是
属于强电解质的是能导电的是
(2)上述九种物质中有两种物质之间可发生离子反应:H++OH﹣═H2O,该离子反应对应的化学方程式为 .
(3)⑩在水中的电离方程式为 , 34.2g⑨溶于水配成250mL溶液,SO42﹣的物质的量浓度为 .
(4)少量的④通入⑥的溶液中反应的离子方程式为: .
(5)将⑩的溶液加入⑥的溶液中至溶液中的Ba2+离子恰好完全沉淀时反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(多选)某密闭容器中发生反应:X(g)+Y(g)3Z(g)△H<0如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( ) 
A.t2时加入了催化剂
B.t3时降低了温度
C.t5时增大了压强
D.t4~t5时间内转化率最低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com