
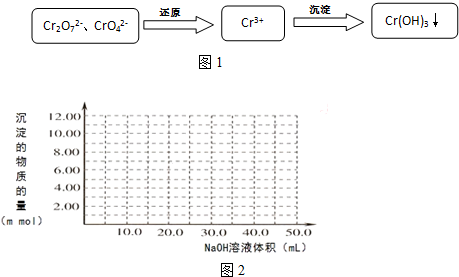
分析 (1)根据化学平衡常数K=$\frac{c(Cr{\;}_{2}O{\;}_{7}{\;}^{2-})}{c(CrO{\;}_{4}{\;}^{2-}){\;}^{2}c(H{\;}^{+}){\;}^{2}}$进行计算;
(2)根据二氧化硫具有还原性,在酸性溶液中通SO2将Cr2O72-还原生成硫酸根和三价铬离子;根据Ksp[Cr(OH)3]=10-32计算c(OH-),从而计算PH;
(3)Cr(OH)3溶于稀硫酸生成硫酸铬和水,根据反应的量画出生成沉淀的物质的量与加入NaOH溶液体积的关系图.
解答 解:(1)若常温下pH=1溶液中Cr2O72-浓度为0.1mol•L-1,Cr2O72-浓度是CrO42-浓度的10倍即CrO42-浓度为0.01mol•L-1,化学平衡常数K=$\frac{c(Cr{\;}_{2}O{\;}_{7}{\;}^{2-})}{c(CrO{\;}_{4}{\;}^{2-}){\;}^{2}c(H{\;}^{+}){\;}^{2}}$=$\frac{0.1}{0.01{\;}^{2}×0.1{\;}^{2}}$=1.0×105,故答案为:1.0×105;
(2)因为二氧化硫具有还原性,在酸性溶液中通SO2将Cr2O72-还原生成硫酸根和三价铬离子,所以离子方程式为:3SO2+Cr2O72-+2H+=2Cr3++3SO42-+H2O;因为Ksp[Cr(OH)3]=10-32,所以c(OH-)=$\root{3}{\frac{10{\;}^{-32}}{10{\;}^{-5}}}$=10-9mol•L-1,则PH=5,故答案为:3SO2+Cr2O72-+2H+=2Cr3++3SO42-+H2O;5;
(3)Cr(OH)3溶于稀硫酸生成硫酸铬和水,化学方程式为2Cr(OH)3+3H2SO4=2Cr2(SO4)3+6H2O,往100.00mL 0.1000mol•L-1CrCl3溶液滴加1.000mol•L-1NaOH溶液,根据反应Cr3++3OH-=Cr(OH)3,Cr(OH)3+OH-=CrO2-+2H2O,所以应该为三份沉淀,一份溶解,生成沉淀的物质的量与加入NaOH溶液体积的关系图为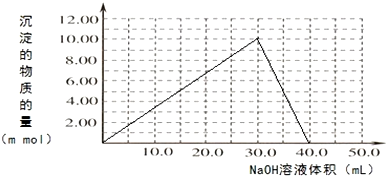 ,故答案为:2Cr(OH)3+3H2SO4=2Cr2(SO4)3+6H2O;
,故答案为:2Cr(OH)3+3H2SO4=2Cr2(SO4)3+6H2O; .
.
点评 本题考查了平衡常数的计算、氧化还原反应等知识点,难度不大,氧化还原反应方程式的书写是高考的热点.


科目:高中化学 来源: 题型:选择题
| A. | ①⑦ | B. | ①⑧ | C. | ②⑧ | D. | ⑤⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
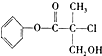 ,下列叙述正确的是( )
,下列叙述正确的是( )| A. | 有机物A属于芳香烃 | |
| B. | 有机物A和浓硫酸混合加热,可以发生消去反应 | |
| C. | 有机物A中含有两种官能团 | |
| D. | l mol A和足量的NaOH溶液反应,最多可以消耗3 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
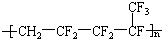 ,则合成它的单体是( )
,则合成它的单体是( )| A. | 氟乙烯和全氟丙烯 | B. | 1,1-二氟乙烯和全氟丙烯 | ||
| C. | 全氟异戊二烯 | D. | 1-三氟甲基-1,3-丁二烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 水中溶解性 |
| 正丁醇 | 74 | 0.80 | 117.3 | 微溶 |
| 正溴丁烷 | 137 | 1.27 | 101.6 | 难溶 |
| 溴化氢 | 81 | --- | --- | 极易溶解 |
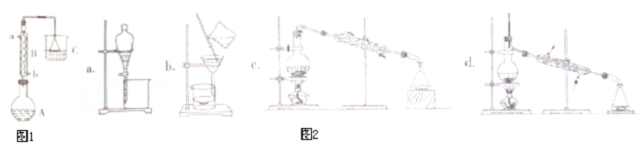
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
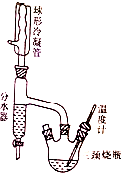 实验室制备正丁醚的原理如下:
实验室制备正丁醚的原理如下:| 物质 | 密度/g•mL-1 | 熔点/℃ | 沸点/℃ | 水溶性 |
| 正丁醇 | 0.81 | -89.8 | 117.7 | 微溶于水 |
| 正丁醚 | 0.769 | -98 | 142 | 不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M为H2O | |
| B. | 每还原1 mol氧化剂,就有3 mol电子转移 | |
| C. | 还原性:SnCl2>As | |
| D. | 氧化产物和还原产物的物质的量之比为2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
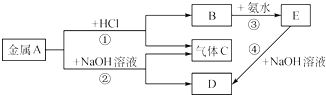
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com