
【题目】已知![]() 、
、![]() 、Z-、W2四种离子均具有相同的电子层结构
、Z-、W2四种离子均具有相同的电子层结构![]() 下列关于X、Y、Z、W四种元素的描述,不正确的是
下列关于X、Y、Z、W四种元素的描述,不正确的是![]()
![]()
A.原子序数:Y>X>Z>WB.离子半径:X+>Y2+>Z->W2-
C.原子最外层电子数:Z>W>Y>XD.还原性:X>Y>W2->Z-
【答案】B
【解析】
X+、Y2+、Z﹣、W2﹣四种离子均具有相同的电子层结构,所以Z、W的电子层比X、Y少一层,设原子序数分别为a、b、c、d,则由a-1=b-2=c+1=d+2,则原子序数Y>X>Z>W,结合元素周期律的递变规律解答该题。
X+、Y2+、Z﹣、W2﹣四种离子均具有相同的电子层结构,所以Z、W的电子层比X、Y少一层,设原子序数分别为a、b、c、d,则由a﹣1=b﹣2=c+1=d+2,则原子序数Y>X>Z>W,
A.结合以上分析可知,原子序数:Y>X>Z>W,故A正确;
B.核外电子排布相同的离子,其微粒半径随原子序数的增大而减小,应该是W>Z>X>Y,故B错误;
C.根据离子所带电荷可知X、Y、Z、W原子最外层电子数分别为1、2、7、6,则原子最外层电子数Z>W>Y>X,故C正确;
D.同周期元素从左到右金属性逐渐减弱,非金属性逐渐增强;元素的非金属性越强,对应的阴离子的还原性越弱,所以还原性:X>Y>W2->Z-,故D正确;
故答案选B。


科目:高中化学 来源: 题型:
【题目】我国古代劳动人民在生产生活中积累了丰富的经验,很多生产过程的操作方法与化学实验中的物质分离除杂方法相似。下列加有着重号的文字与对应分离方法正确的是( )
《本草集经注》 | 《通州煮海录》 | 《名医别录》 | 《续遵义府志》 |
凡渍药酒,皆须细切……便可漉出 | 海陆取卤,日晒火煎,煮海熬波,卤水成盐 | 凡煮汤,欲微火,令小沸……箅渣取液 | 经月画出蒸之……终乃得酒可饮 |
|
|
|
|
A.过滤、蒸馏、萃取、蒸发B.过滤、蒸发、萃取、蒸馏
C.蒸发、萃取、蒸馏、过滤D.萃取、蒸发、过滤、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煅烧硫酸亚铁反应为2FeSO4 ![]() SO2↑+SO3↑+Fe2O3,有关说法不正确的是
SO2↑+SO3↑+Fe2O3,有关说法不正确的是
A.该反应中FeSO4既作氧化剂又作还原剂
B.SO2能使酸性KMnO4溶液褪色,说明SO2具有还原性
C.该反应中每生成1 mol Fe2O3转移电子数为2×6.02×1023
D.将反应生成的气体通入BaCl2溶液中,无沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某样品中氟元素的质量分数进行如下实验,利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(氢氟酸为低沸点酸,含量低,不考虑对玻璃仪器的腐蚀),用水蒸气蒸出,再通过滴定测量。实验装置如下图所示,加热装置省略。
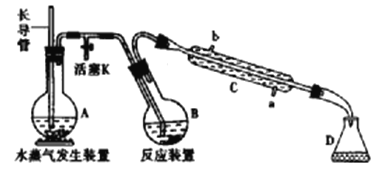
(1)A的名称是___________,长导管用于平衡压强,实验过程中其下端___________(填“能”或“不能”)在液面以上。
(2)仪器C是直形冷凝管,实验过程中,冷却水应从___________口出。(填“a”或“b")
(3)实验时,首先打开活塞K,待水沸腾时,关闭活塞K,开始蒸馏:若蒸馏时因反应装置局部堵塞造成长导管水位急剧上升,应立即______________________。
(4)连接水蒸气发生装置和反应装置之间的玻璃管常裹以石棉绳,其作用是___________。
(5)B中加入一定体积高氯酸和1.00g氟化稀土矿样,D中盛有滴加酚酞的NaOH溶液。加热A、B,使A中产生的水蒸气进入B。
①下列物质不可代替高氯酸的是___________(填标号)
a.醋酸 b.硝酸 c.磷酸 d.硫酸
②D中主要反应的离子方程式为_________________________________。
(6)向馏出液中加入25.00mL0.100mol·L-1La(NO3)3溶液,得到LaF3沉淀,再用0.100 mol·L -1EDTA标准溶液滴定剩余La3+(La3+与EDTA按1︰1络合),消耗EDTA标准溶液20.00mL,则氟化稀土样品中氟的质量分数为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳是潜在的碳资源,无论是天然的二氧化碳气藏,还是各种炉气、尾气、副产气,进行分离回收和提浓,合理利用,意义重大。
(1)在空间站中常利用CO2(g)+2H2(g)![]() C(s)+2H2O(g),再电解水实现O2的循环利用,350℃时,向体积为2L的恒容密闭容器中通入8molH2和4molCO2发生以上反应。
C(s)+2H2O(g),再电解水实现O2的循环利用,350℃时,向体积为2L的恒容密闭容器中通入8molH2和4molCO2发生以上反应。
①若反应起始和平衡时温度相同(均为350℃),测得反应过程中压强(p)随时间(t)的变化如图中a所示,则上述反应的△H___________0(填“>”或“<”);其他条件相同时,若仅改变某一条件,测得其压强(p)随时间(t)的变化如图中曲线b所示,则改变的条件是___________。
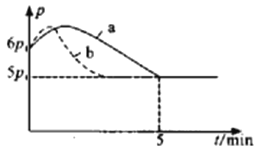
②图是反应平衡常数的对数与温度的变化关系图,m的值为___________。

(2)CO2在 Cu-ZnO催化下,同时发生如下反应I,II,是解决温室效应和能源短缺的重要手段。
Ⅰ.CO2(g)+3H2(g)![]() CH3OH (g)+H2O(g) △H1<0
CH3OH (g)+H2O(g) △H1<0
Ⅱ.CO2(g)+H2(g)![]() CO(g)+ H2O(g) △H2>0
CO(g)+ H2O(g) △H2>0
保持温度T时,在容积不变的密闭容器中,充入一定量的CO2及H2,起始及达平衡时,容器内各气体物质的量及总压强如下表:

若反应I、II均达平衡时,p0=1.4p,则表中n=__________;反应1的平衡常数Kp=____ (kPa)-2。(用含p的式子表示)
(3)Al-CO2电池是一种以低温熔融盐[Al2(CO3)3]为电解质,以完全非碳的钯Pd包覆纳米多孔金属为催化剂正极的可充电电池。正极反应为:3CO2+4e-=2CO32-+C,则生成Al的反应发生在___________极(填“阳”或“阴”),该电池充电时反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示。A是红棕色固体,B是常见的强酸,C是常见的无色液体。E、F均为无色有刺激性气味的气体,其中E能使品红溶液褪色。G可用作补血剂,I是一种白色固体,在空气中最终变成红褐色。请回答下列问题:


(1)F的电子式为_____。
(2)写出反应②的离子方程式,并用单线桥标出电子转移的方向和数目_____。
(3)可确定反应②中金属离子已完全反应的试剂为_____(填化学式)。反应③的装置如上图所示,倒置漏斗的作用是_____。
(4)写出反应③的离子方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氨肥样品可能含有NH4HCO3、NH4Cl、.NH4NO3中的一种或几种。称取该样品1.000克,溶于水配成100mL溶液,将溶液分成两等份依次完成如下实验:
①向一份溶液中加入10mL0.2 mol·L-1的盐酸与之充分反应,可收集到标准状况下的CO2气体44.8mL(设产生的CO2全部逸出)。
②向另一份溶液中加入足量的6mol·L-1氢氧化钠溶液,加热,产生的气体(设产生的NH3全部逸出)至少需要25mlL0.15 mol·L-1的硫酸才能被完全反应。下列说法正确的是
A. 1.000g样品中一定含有NH4HCO30.316克
B. 向①反应所得的溶液中加入硝酸酸化的硝酸银溶液,若有白色沉淀生成,说明原样品中一定含有NH4Cl
C. 原样品的含氨量为21%
D. 无需另外再设计实验验证,就能确定原样品中是否含有NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某饱和溶液的以下条件:①溶液的质量、②溶剂的质量、③溶液的体积、④溶质的摩尔质量、⑤溶质的溶解度、⑥溶液的密度,其中不能用来计算该饱和溶液的物质的量浓度的组合是( )
A. ④⑤⑥ B. ①②③④ C. ①③④ D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列卤代烃在KOH醇溶液中加热不发生消去反应的是( )
①![]() ②
② ③(CH3)3CCH2Cl ④CHCl2-CHBr2 ⑤
③(CH3)3CCH2Cl ④CHCl2-CHBr2 ⑤![]() ⑥CH3Cl
⑥CH3Cl
A.①③⑥B.②③⑤C.全部D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com