
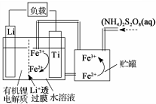
| A. | Li+透过膜除允许Li+通过外,还允许H2O分子通过 | |
| B. | 放电时,进入贮罐的液体发生:S2O32-+2Fe2+=2Fe3++2SO42- | |
| C. | 充电时,钛电极与外电源的正极相连 | |
| D. | 充电时,电池内部发生的总反应为Li++Fe2+=Li+Fe3+ |
分析 该电池的负极是金属锂,离子交换膜至于许离子经过,不允许分子经过,在负极上是金属锂失电子的氧化反应,电极反应式为:Li-e-=Li+,正极上是铁离子得电子的还原反应,即Fe3++e-=Fe2+,两极反应相加,可得到总反应,在二次电池充电时,原电池的负极和电源的负极相连,原电池的正极和电源的负极相连,据此回答.
解答 解:A、该电池的负极是金属锂,Li+透过膜除允许Li+通过,不允许H2O分子通过,故A错误;
B、放电时,正极上得电子的还原反应,即Fe3++e-=Fe2+,S2O32-+2Fe2+=2Fe3++2SO42-中只存在化合价升高的元素,没有化合价降低的元素,不符合氧化还原反应特点,故B错误;
C、钛电极是电池的正极,充电时,应该与外电源的正极相连,故C正确;
D、负极上是金属锂失电子的氧化反应,电极反应式为:Li-e-=Li+,正极上是铁离子得电子的还原反应,即Fe3++e-=Fe2+,两极反应相加,可得到总反应为Li++Fe2+=Li+Fe3+,故D正确.
故选A.
点评 本题考查学生原电池和电解池的工作原理知识,属于综合知识的考查,难度不大.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:填空题
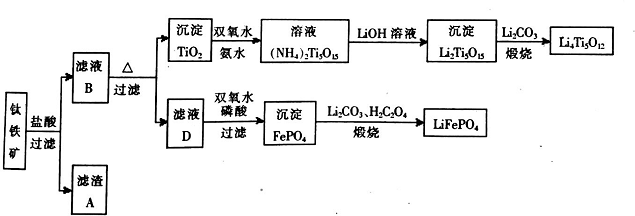
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
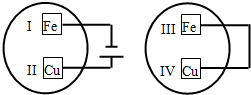 把铁片和铜片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所示),经一段时间后,观察到溶液变红的区域是( )
把铁片和铜片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所示),经一段时间后,观察到溶液变红的区域是( )| A. | II和III附近 | B. | II和IV附近 | C. | I和III附近 | D. | I和IV附近 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
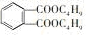 ),过量摄入塑化剂会对肝肾功能造成影响,甚至诱发癌症.下列有关说法正确的是( )
),过量摄入塑化剂会对肝肾功能造成影响,甚至诱发癌症.下列有关说法正确的是( )| A. | DBP的分子式为C16H22O4 | |
| B. | 1mol DBP可以与5molH2反应 | |
| C. | 1mol DBP在碱性条件下水解时消耗4molNaOH | |
| D. | DBP所有原子在同一平面内 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末,溶于浓盐酸会生成HCuCl2,常用作催化剂.实验室可用废铜屑、浓盐酸、食盐及氧气制取CuCl.已知KMnO4不与稀盐酸反应,回答下列问题:
氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末,溶于浓盐酸会生成HCuCl2,常用作催化剂.实验室可用废铜屑、浓盐酸、食盐及氧气制取CuCl.已知KMnO4不与稀盐酸反应,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH(CH2Br)2 | B. | CH3CH2CHBrCH2Br | C. | H3CHBrCHBrCH3 | D. | CH2BrCBr(CH3)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com