
| ||
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶物 |
| 质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |
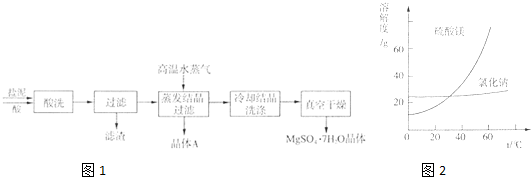
| 1371g |
| x |
| 100g+37.1g |
| 37.1g |
| 117 |
| 351 |
| 80 |
| m |
| 1152g |
| 1.37g?cm -3 |
| 1371g |
| x |
| 100g+37.1g |
| 37.1g |
| 117 |
| 351 |
| 80 |
| m |
| 1152g |
| 1.37g?cm -3 |
| n |
| V |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ①CH3COOH | ②H2CO3 | ③H2S | ④H4PO4 |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④⑤ | B、③⑥ |
| C、②④⑤ | D、②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ⑦ | ? | ||||||
| 三 | ① | ③ | ⑤ | ⑥ | ⑧ | ⑩ | ||
| 四 | ② | ④ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.01mol?L-1醋酸溶液 |
| B、0.02mol?L-1醋酸与0.01mol?L-1NaOH溶液等体积混合液 |
| C、0.03mol?L-1醋酸与0.01mol?L-1NaOH溶液等体积混合液 |
| D、pH=2的盐酸与0.01mol?L-1NaOH溶液等体积混合液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.01 mol?L-1 |
| B、0.02 mol?L-1 |
| C、1×10-12 mol?L-1 |
| D、5×10-13 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
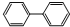 ,下列有关联苯的说法中正确的是( )
,下列有关联苯的说法中正确的是( )| A、分子中含有6个碳碳双键 |
| B、联苯的一硝基取代产物的3种 |
| C、它容易发生加成反应、取代反应,容易被强氧化剂氧化 |
D、它和蒽(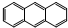 )同属于芳香烃,两者互为同系物 )同属于芳香烃,两者互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:A<B<C |
| B、C的最简单氢化物的稳定性大于A的最简单氢化物的稳定性 |
| C、高温下,A单质能置换出C单质 |
| D、三种元素的最高价氧化物对应的水化物均可由化合反应得到 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com