
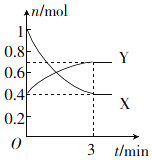
 一定温度下,在体积为0.5L的恒容密闭容器中,NO2和N2O4之间发生反应:2NO2 (g)(红棕色)?N2O4 (g)(无色),反应过程中各物质的物质的量与时间的关系如图所示.
一定温度下,在体积为0.5L的恒容密闭容器中,NO2和N2O4之间发生反应:2NO2 (g)(红棕色)?N2O4 (g)(无色),反应过程中各物质的物质的量与时间的关系如图所示.分析 (1)可根据3min内物质的量的变化判断,物质的量的变化量之比等于计量数之比;
(2)Y为NO2的变化曲线,在0~3min内变化0.6mol;
(3)达到平衡时,正逆反应速率相等,各物质的浓度、含量不变;
(4)降低温度,正逆反应速率都减小.
解答 解:(1)由方程式N2O4(g)?2NO2 (g),可知反应中NO2 的物质的量变化较大,则Y表示NO2的物质的量随时间的变化曲线,故答案为:Y;
(2)Y为NO2的变化曲线,在0~3min内变化0.6mol,则v=$\frac{\frac{0.6mol}{0.5L}}{3min}$=0.4 mol/(L•min),故答案为:0.4 mol/(L•min);
(3)a.反应前后体积变化,容器内压强不再发生变化,可说明达到平衡状态,故a正确;
b.NO2的体积分数不再发生变化,可说明达到平衡状态,故b正确;
c.无论是否达到平衡状态,容器内原子总数都不发生变化,故c错误;
d.无论是否达到平衡状态,相同时间内消耗nmolN2O4的同时生成2nmol NO2,不能说明达到平衡状态,故d错误
故答案为:ab;
(4)降低温度,正逆反应速率都减小,故答案为:减小;减小.
点评 本题考查较为综合,涉及化学平衡的图象以及平衡状态的判断,侧重考查学生的分析能力,题目难度中等,注意把握化学反应速率以及化学平衡的基本知识即可解答该题.


科目:高中化学 来源: 题型:选择题
| A. | 用品红溶液鉴别SO2和CO2两种气体 | |
| B. | 用丁达尔效应鉴别FeCl3溶液和Fe(OH)3胶体 | |
| C. | 加热可除去Na2CO3固体中少量的NaHCO3 | |
| D. | 向某溶液中先加少量氯水,再滴加KSCN溶液后变红,则原溶液中一定含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
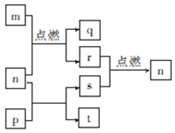 短周期元素W、X、Y、Z的原子序数依次增大,其中Z为金属且Z的原子序数为W的2倍.n、p、q是由这些元素组成的二元化合物,常温下n为气体.m、r、s分别是Z、W、X的单质,t的水溶液显碱性且焰色反应呈黄色,上述物质间的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大,其中Z为金属且Z的原子序数为W的2倍.n、p、q是由这些元素组成的二元化合物,常温下n为气体.m、r、s分别是Z、W、X的单质,t的水溶液显碱性且焰色反应呈黄色,上述物质间的转化关系如图所示.下列说法正确的是( )| A. | 原子半径:Z>Y | |
| B. | 化合物p中只存在离子键 | |
| C. | 图示转化关系涉及的反应均为氧化还原反应 | |
| D. | 最简单气态氢化物的稳定性:W>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 |
| A | 称取2.0g NaOH固体 | 先在左、右两托盘上各放一张滤纸,然后在有盘上添加2g砝码,左盘上添加NaOH固体 |
| B | 检验试液巾是否含有NH4+ | 取少量试液于试管巾,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 |
| C | 除去CO2中混有的杂质SO2 | 将混合气体通入盛有澄清石灰水的洗气瓶中 |
| D | 验证金属钠比铜活泼 | 将钠加入1.0mol•L-1的CuSO4溶液中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl H2O CO2 | B. | NaCl MgCl2 Na2O | ||
| C. | H2O Na2O CO2 | D. | CaCl2 NaOH H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com