

| A. | ①中加人试剂顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液 | |
| B. | 过程②为电解熔融精盐 | |
| C. | 工业上过程③加入的试剂为浓NaOH溶液 | |
| D. | 第④步反应的离子方程式可表示为:2Br-+Cl2=Br2+2Cl- |
分析 海水蒸发溶剂得到粗盐和母液,粗盐通过精制得到精盐,电解饱和食盐水得到氯气、氢气和氢氧化钠;母液加氢氧化钙反应生成氢氧化镁沉淀,母液通入氯气氧化溴离子为溴单质,
A.过程①加入的药品顺序为BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸;
B.过程②是电解饱和食盐水得到氢氧化钠溶液;
C.工业上过程③加入的试剂为氢氧化钙,用来沉淀镁离子;
D.第④步反应是利用氧化剂氧化溴离子生成溴单质.
解答 解:A.过程①加入的药品顺序为BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸,如果再过滤沉淀前加入过量BaCl2溶液,稀盐酸不能除去氯化钡溶液,所以会产生杂质,故A错误;
B.过程②是电解饱和食盐水得到氢氧化钠溶液,电解熔融精盐生成钠和氯气,故B错误;
C.工业上过程③加入的试剂为氢氧化钙溶液,氢氧化钠溶液是强腐蚀性,经济效益不好,故C错误;
D.第④步反应是利用氧化剂氧化溴离子生成溴单质,反应的离子方程式可表示为:2Br-+Cl2=Br2+2Cl-,故D正确;
故选D.
点评 本题考查了海水资源的利用、原理分析判断、试剂选择和杂质除去方法,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | AgCl固体在等物质的量浓度的NaCl、MgCl2溶液中的溶度积相同 | |
| B. | 在0.1mol/L的NaOH溶液中,由水电离出的c(H+)>$\sqrt{{K}_{W}}$ | |
| C. | 将NH4Cl溶液从20℃升温至30℃,溶液中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}$增大 | |
| D. | CH3COONa和盐酸两溶液混合后,呈中性的混合溶液中:c(Na+)=c(Cl-)>c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |||
| Z | W | Q |
| A. | X与Y形成的阴离子有XY32-、X2Y42- | |
| B. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| C. | Q与Y可形成一种高效安全灭菌消毒剂 | |
| D. | W的最高价氧化物对应水化物的酸性比Q的弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 现象 | 结论 | |
| A | 向25mL沸水中滴加5~6滴 FeCl3饱和溶液,持续加热煮沸 | 变为红褐色 | 最终制得 Fe(OH)3 胶体 |
| B | 欲收集酯化反应生成的乙酸乙酯并分离提纯,将导管伸入饱和Na2CO3溶液的液面下,再用分液漏斗分离 | 溶液分层,上层为无色油状液体 | 乙酸乙酯不溶于饱和Na2CO3 溶液,且密度比水小 |
| C | 淀粉溶液中加入几滴稀硫酸,水浴加热几分钟,再加入新制银氨溶液,水浴加热 | 无明显现象 | 淀粉未发生水解 |
| D | 两支盛有KI3溶液的向试管中,分别滴加淀粉溶液和AgNO3溶液 | 前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡: I3-?I2+I- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池反应为Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O,放电时负极质量减轻 | |
| B. | 电解精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| C. | CH3COONa稀溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$ 的值增大 | |
| D. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙二醇与丙三醇互为同系物 | B. | 乙烯和丙烯具有相似的化学性质 | ||
| C. | 淀粉和纤维素属于同分异构体 | D. | 乙酸与甲酸甲酯均易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
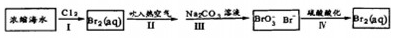
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
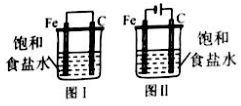
| A. | 两个装置中Fe棒上发生的反应相同 | |
| B. | 图 I中铁比图 II中铁腐蚀更快 | |
| C. | 两个装置中C棒上均明显有气体逸出 | |
| D. | 两个装置中Fe均是负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的热稳定性:E>d>J | |
| B. | 原子半径:G>E>J>D | |
| C. | 最高价氧化物对应水化物的酸性:J>D>G | |
| D. | E和J组成的化合物常作食品的干燥剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com