
【题目】将一定质量的镁铝合金投入![]() 一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为
一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为![]() 的
的![]() 溶液,生成的沉淀跟加入的
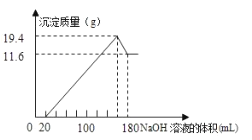
溶液,生成的沉淀跟加入的![]() 溶液的体积关系如图。(横坐标体积单位是
溶液的体积关系如图。(横坐标体积单位是![]() ,纵坐标质量单位是g)求:
,纵坐标质量单位是g)求:
(1)合金中![]() ,
,![]() 的质量_____________
的质量_____________
(2)所用![]() 的物质的量浓度___________
的物质的量浓度___________
【答案】4.8g ;![]()
![]()
【解析】
由图可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、AI后,盐酸有剩余,此时发生的反应为: HCl+ NaOH= NaCl+ H2O ;继续滴加NaOH溶液,到氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg (OH) 2和Al (OH)3,溶液为氯化钠溶液,再继续滴加NaOH溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应为: Al (OH)3+ NaOH=NaAlO2+2H2O ,据此分析作答;
(1 )由上述分析可知,从加入20mL氢氧化钠溶液开始产生沉淀,加入氢氧化钠溶液为160 mL时,沉淀量最大,此时为Mg (OH) 2和Al (OH)3,该阶段消耗氢氧化钠140 mL ,由氢氧根守恒可知: 3n[Al (OH)3]+2n[Mg (OH) 2]=n ( NaOH)= ( 0.16L-0.02L ) ![]() 5 mol/L=0.7 mol ;从加入氢氧化钠溶液160mL ~ 180mL溶解氢氧化铝,该阶段发生反应: Al (OH)3+ NaOH=NaAlO2+2H2O,所以n[Al (OH)3]= ( 0.18L-0.16L )
5 mol/L=0.7 mol ;从加入氢氧化钠溶液160mL ~ 180mL溶解氢氧化铝,该阶段发生反应: Al (OH)3+ NaOH=NaAlO2+2H2O,所以n[Al (OH)3]= ( 0.18L-0.16L ) ![]() 5mol/L=0.1 mol,由元素守恒规律可知n (Al) =n[Al (OH)3]= 0.1 mol,故Al的质量为:0.1mol
5mol/L=0.1 mol,由元素守恒规律可知n (Al) =n[Al (OH)3]= 0.1 mol,故Al的质量为:0.1mol ![]() 27g/mol= 2.7g;同理可求出n[Mg (OH) 2]=0.2mol ,由元素守恒可知n (Mg) =n[Mg (OH) 2]=0.2mol ,所以Mg的质量为: 0.2mol
27g/mol= 2.7g;同理可求出n[Mg (OH) 2]=0.2mol ,由元素守恒可知n (Mg) =n[Mg (OH) 2]=0.2mol ,所以Mg的质量为: 0.2mol ![]() 24g/mol= 4.8g,故答案为:4.8g、2.7g;
24g/mol= 4.8g,故答案为:4.8g、2.7g;
(2)沉淀量最大,溶液为氯化钠溶液,根据钠元素守恒可知,此时溶液中n ( NaCl) =n ( NaOH) =0.16L![]() 5mol/L=0.8mol ,根据氯离子守恒:n( HCl) =n( NaCl ) =0.mol ,故盐酸的物质的量浓度为:
5mol/L=0.8mol ,根据氯离子守恒:n( HCl) =n( NaCl ) =0.mol ,故盐酸的物质的量浓度为: ![]() =8mol/L,故答案为:
=8mol/L,故答案为:![]() 。
。


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
【题目】反应4NH3+5O2![]() 4NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率v(v表示反应物的消耗速率或生成物的生成速率)为
4NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率v(v表示反应物的消耗速率或生成物的生成速率)为
A. (NH3)= 0.002mol/(L·s)B. (O2)= 0.01mol/(L·s)
C. (NO)= 0.008mol/(L·s)D. (H2O)= 0.004mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,14 g 由N2与CO组成的混合气体含有的原子数目为NA
B.高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
C.标准状况下,11.2L水中含有分子的数目为0.5NA
D.在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
下列说法不正确的是

A. 固体1中主要含有Ca(OH)2、CaCO3、CaSO3
B. X可以是空气,且需过量
C. 捕获剂所捕获的气体主要是CO
D. 处理含NH4+废水时,发生反应的离子方程式为:NH4++NO2-==N2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2的实验,其流程如下:
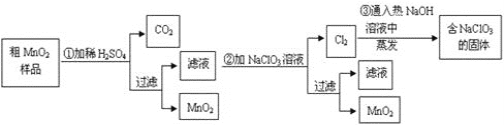
(1)第①步加稀H2SO4时,粗MnO2样品中的____(写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式:_________
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、酒精灯 、______、______,已知蒸发得到的固体中有NaClO3和NaOH,则一定还有____(写物质名称)。
(4)若粗MnO2样品的质量为12.69 g,第①步反应后,过滤得到8.7 gMnO2,并收集到0.224 L CO2(标准状况),则第②步反应中至少需要_______ g NaClO3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可通过反应:3Cl2+6KOH![]() 5KCl+KC1O3+3H2O 制取KC1O3,再用稍潮湿KC1O3和草酸(H2C2O4) 在60℃时反应制取ClO2气体,装置如图所示。ClO2是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。
5KCl+KC1O3+3H2O 制取KC1O3,再用稍潮湿KC1O3和草酸(H2C2O4) 在60℃时反应制取ClO2气体,装置如图所示。ClO2是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。
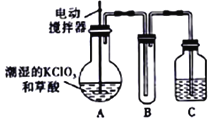
请回答下列问题:
(1)A 中反应的主要产物有:某种正盐、ClO2和CO2等,写出该反应的化学方程式:_____。
(2)请分析装置图,进行补充和完善。A部分缺________装置,B部分还应补充_______装置,还有一处设计明显不合理的是___________(填“A”“B”或“C”)。
(3)C中的试剂为NaOH溶液时,反应生成NaClO3和NaClO2,写出该反应的离子方程式____。
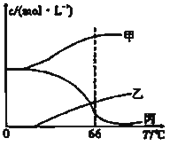
(4)在密闭容器中向9℃的KOH溶液中通入少量Cl2,此时Cl2的氧化产物主要是______;继续通入适量Cl2,将溶液加热,溶液中主要离子的浓度随温度的变化如图所示,图中甲、乙、丙依次表示的离子是__________、__________、__________(不考虑Cl2的挥发)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A.在NaCl晶体中,距Na+最近的Cl-形成正八面体
B.在金刚石晶体中,最小碳原子环由6个碳原子构成
C.在石墨晶体中,每个环上平均占有3个碳原子
D.银晶体晶胞如图,银原子的配位数为12
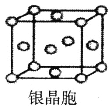
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁镁合金是目前已发现的储氢密度较高的储氢材料之一,其晶胞结构如图所示(黑球代表Fe,白球代表Mg)。则下列说法不正确的是

A.铁镁合金的化学式为Mg2Fe
B.晶体中存在的化学键类型为共价键
C.晶格能:氧化镁>氧化钙
D.该晶胞的质量是![]() g(NA表示阿伏加德罗常数的值)
g(NA表示阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据要求回答下列问题:
(1)现有某XY3气体a g,它的摩尔质量为b g·mol-1。若阿伏加德罗常数用NA表示,则:该气体的物质的量为________,该气体在标准状况下的体积为__________;该气体溶于水后形成V L溶液,其溶液的物质的量浓度为________________。
(2)等质量的O2和O3所含分子数之比为________,所含原子数之比为_________。
(3)某气体氧化物的化学式为RO2,在标准状况下,1.28 g该氧化物的体积为448 mL,则该氧化物的摩尔质量为__________,R的相对原子质量为__________。
(4)在标准状况下,有CO和CO2组成的混合气体8.96 L,质量是16 g,此混合物中CO和CO2的物质的量比是________,C和O原子个数比是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com