
| A. | 溶液质量减轻 | |
| B. | Fe3+的氧化性大于Cu2+ | |
| C. | 溶液中Cu2+与Fe2+的物质的量比为1:1 | |
| D. | 1molFe可还原2molFe3+ |
分析 根据金属活动顺序表可知氧化性:Zn2+<Cu2+<Ag+,且存在Cu2+<Fe3+<Ag+,充分搅拌后Fe完全反应,且Fe3+和Ag+完全反应:2Ag++Fe═Fe2++2Ag,2Fe3++Fe═3Fe2+,
A.加入0.1molFe,析出0.1molAg,析出固体的质量大于溶解金属的质量,则溶液质量减小;
B.金属活动顺序表中,排在后面的金属离子氧化性越强;金属铜和三价铁反应生成氯化铜和氯化亚铁,氧化剂的氧化性强于氧化产物的氧化性;
C.加入的0.1mol优先与银离子、铁离子反应,铁离子不参与反应,据此进行计算;
D.根据得失电子守恒分析解答.
解答 解:A.0.1mol铁的质量为5.6g,0.1mol银的质量为10.8g,则溶液质量增加了5.6g,减少了10.6g,最终导致溶液质量减轻,故A正确;
B.根据金属活动顺序表可知氧化性:Zn2+<Cu2+<Ag+,金属铜能够和三价铁离子反应生成氯化铜和氯化亚铁,则氧化性Cu2+<Fe3+,故B正确;
C.氧化性Cu2+<Ag+,Fe先还原Ag+,然后还原铁离子;由反应2Ag++Fe═Fe2++2Ag,2Fe3++Fe═3Fe2+可知,反应后总共生成0.2molFe2+,而0.1molCu2+没有参加反应,则反应后溶液中Cu2+与Fe2+的物质的量之比为1:2,故C错误;
D.1molFe转移2mol的电子,而1molFe3+得到1mol的电子,所以可还原2molFe3+,故D正确;
故选C.
点评 本题考查混合物反应的计算与判断,题目难度中等,试题侧重于学生的分析能力和计算能力的考查,为高频考点,注意把握物质的氧化性的强弱,为解答该题的关键,结合反应的方程式解答该题.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
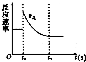 如图表示可逆反应A(g)+3B(g)?2C(g)△H<0达平衡后,t1时改变某一反应条件,反应速率随时间变化的情况,根据曲线判断下列说法中正确的是( )
如图表示可逆反应A(g)+3B(g)?2C(g)△H<0达平衡后,t1时改变某一反应条件,反应速率随时间变化的情况,根据曲线判断下列说法中正确的是( )| A. | t1时降低了温度,平衡向正反应方向移动 | |
| B. | t1时增大了压强,平衡向正反应方向移动 | |
| C. | t1时可能使用了催化剂 | |
| D. | t1时增大了A的浓度,同时减小了C的浓度,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯度的硅单质广泛用于制造光导纤维 | |
| B. | SiO2是酸性氧化物,不溶于任何酸 | |
| C. | 水泥、玻璃、水晶饰物都是硅酸盐制品 | |
| D. | 石灰石是生产玻璃和水泥的主要原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠常用于远途运输鱼苗的供氧 | |
| B. | 侯式制碱法的工艺过程中应用了物质的溶解性差异 | |
| C. | 加工后具有吸水性的植物纤维可用作食品干燥剂 | |
| D. | 使用含有钙离子浓度较大的地下水洗衣服,肥皂的去污能力减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
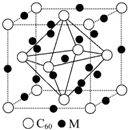 硼及其化合物的研究在无机化学的发展中占有独特的地位.
硼及其化合物的研究在无机化学的发展中占有独特的地位. H++B(OH)4-
H++B(OH)4-查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属的电化学腐蚀比化学腐蚀更普遍 | |
| B. | 航海船船底四周镶嵌锌块保护船体,利用的是牺牲阳极保护法 | |
| C. | 用铝制铆钉连接铁板,铝钉易被腐蚀 | |
| D. | 原电池中电子由正扱流入负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
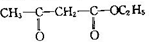 )和聚乙烯醇(PVA)都是重要的有机化工产品,其合成路线如图所示.
)和聚乙烯醇(PVA)都是重要的有机化工产品,其合成路线如图所示.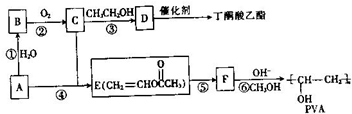
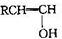 不稳定会自动转化为RCH2CHO.
不稳定会自动转化为RCH2CHO.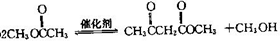
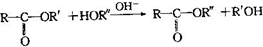
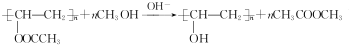 ,该反应的反应类型为取代反应.
,该反应的反应类型为取代反应.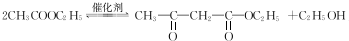 ,Na与生成的乙醇反应,平衡右移,提高D的转化率.(根据化学方程式和平衡移动原理回答)
,Na与生成的乙醇反应,平衡右移,提高D的转化率.(根据化学方程式和平衡移动原理回答) 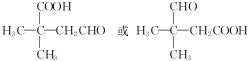 (填结构简式).
(填结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
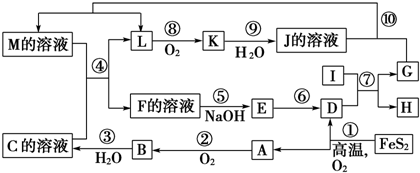
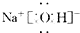
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com