
 ��1���жϺ���������ǿ����һ����������ǣ���������ӽṹ�к����ǻ���ԭ����Խ�࣬�ú���������Ծ�Խǿ������������ǿ������ǻ���ԭ�����Ĺ�ϵ���±���ʾ��
��1���жϺ���������ǿ����һ����������ǣ���������ӽṹ�к����ǻ���ԭ����Խ�࣬�ú���������Ծ�Խǿ������������ǿ������ǻ���ԭ�����Ĺ�ϵ���±���ʾ��| ���� | ������ | ���� | ���� | ������ |
| �ṹʽ | Cl-OH |  |  |  |
| ���ǻ���ԭ���� | 0 | 1 | 2 | 3 |
| ���� | ���� | ��ǿ�� | ǿ�� | ��ǿ�� |
| m |
| V |
 ��
��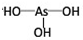 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
�� ��
��| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| m |
| V |
| ||
| V |
| 388 |
| a?NA |
| 3 |
| ||
| ||
| 2 |
| 3 |
| ||
| ||
| 2 |
| 3 |
| ||


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��5 g��������Ϊ46%���Ҵ���Һ�У���ԭ�ӵ�����Ϊ0.6 NA |
| B��5.6 g����0.1 mol������ַ�Ӧת�Ƶ�����Ϊ 0.2 NA |
| C��50 mL 12 mol?L-1 Ũ�����������������̼��ȷ�Ӧ��ת�Ƶ�����Ϊ0.3 NA |
| D�����³�ѹ�£�46 g NO2��N2O4�Ļ�������к��е�ԭ������Ϊ3 NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��1����ӦA+B?2C������AΪ��ɫ��̬���ʣ���������ɫ��dz�뷴Ӧʱ�䣬�¶ȣ�T��֮��Ĺ�ϵ��ͼ��ʾ��B��C��Ϊ��ɫ���ʣ���
��1����ӦA+B?2C������AΪ��ɫ��̬���ʣ���������ɫ��dz�뷴Ӧʱ�䣬�¶ȣ�T��֮��Ĺ�ϵ��ͼ��ʾ��B��C��Ϊ��ɫ���ʣ����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
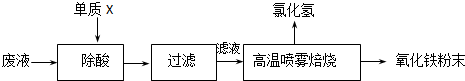
| �������� | Ԥ������ͽ��� |
| ����1��ȡ������Ʒ���Թ�1�У� | ��Ʒȫ���ܽ⣬�õ��������Һ�� |
| ����2�� ����3�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �桢�����ܡ����䲻����ѧ�γ����Ľ���Ԫ�أ����ڹ�ҵ������������Ҫ���ã�
�桢�����ܡ����䲻����ѧ�γ����Ľ���Ԫ�أ����ڹ�ҵ������������Ҫ���ã�| �ŵ� |
| ��� |
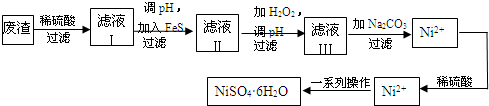
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
| 2 | �� | �� | ||||||
| 3 | �� | �� | �� | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� | �����Լ� | �������� |
| �ٴֱ�������ᴿ | ||
| ���Ҵ���ˮ�� | ||
| ���������������ᣩ | ||
| �����飨��ϩ�� | ||
| �ݱ����ƾ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| A��ç����ķ���ʽΪC7H10O5 |
| B�������к������ֹ����ţ��ɷ���ȡ����Ӧ |
| C���������Ը��������Һ����ç���ᡢ�Ҵ������Ȼ�̼�ͱ� |
| D��1molç����ȿ���2mol���������ӳɷ�Ӧ��Ҳ����4mol NaOH�����кͷ�Ӧ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com