
 .
. .
.
分析 A、B、C、D、E是原子序数依次增大的短周期主族元素,A在周期表中的原子半径最小,则A为H元素;B是地壳中含量最高的元素,则B为O元素;C是短周期中金属性最强的元素,则C为Na;B和E同主族,则E为S元素;C、D、E三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,则D为Al,据此解答.
解答 解:A、B、C、D、E是原子序数依次增大的短周期主族元素,A在周期表中的原子半径最小,则A为H元素;B是地壳中含量最高的元素,则B为O元素;C是短周期中金属性最强的元素,则C为Na;B和E同主族,则E为S元素;C、D、E三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,则D为Al.
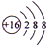
(1)D为Al,在元素周期表中的位置:第三周期ⅢA族,E的离子为S2-,离子结构示意图是 ,
,
故答案为:第三周期ⅢA族; ;
;
(2)C和E能形成化合物乙为Na2S,用电子式表示Na2S的形成过程: ,
,
故答案为: ;
;
(3)O元素原子半径小于S的原子半径,氧原子原子核对核外电子吸引更强,故O的非金属性比硫的强,
故答案为:O元素原子半径小于S的原子半径,氧原子原子核对核外电子吸引更强;
(4)工业电解熔融氧化铝制备单质Al,化学方程式为:2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,
故答案为:2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑;
(5)元素C和D的最高价氧化物的水化物分别为NaOH、Al(OH)3,二者反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
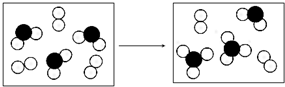
(6)由图可知,该转化过程为SO2与O2反应生成三氧化硫,反应化学方程式为:2SO2+O2$?_{△}^{催化剂}$2SO3,故答案为:2SO2+O2$?_{△}^{催化剂}$2SO3.
点评 本题题考查结构性质位置关系应用,难度中等,推断元素是解题关键,侧重对化学用语的考查,需要学生熟练掌握基础知识.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 2种 | C. | 3种 | D. | 1种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:NH3>PH3>SiH4 | B. | 酸性:HClO4>H2SO4>H3PO4 | ||
| C. | 碱性:KOH>NaOH>Mg(OH)2 | D. | 还原性:F->Cl->Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应 | |
| B. | 氟的非金属性比氯强,其最高价氧化物对应水化物的酸性比HClO4强 | |
| C. | 硒(Se)位于第四周期 VIA,其气态氢化物不如HCl稳定 | |
| D. | 第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2N2(g)+O2(g)═2N2O(g)△H=+163 kJ•mol-1 | |
| B. | 2Ag(s)+Cl2(g)═2AgCl(s)△H=-127 kJ•mol-1 | |
| C. | 2HgO(s)═2Hg(l)+O2(g)△H=+91 kJ•mol-1 | |
| D. | 2H2O2(l)═O2(g)+2H2O(l)△H=-98 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸中放出氢气量最多 | B. | 反应速率H2SO4>HCl>CH3COOH | ||
| C. | 放出氢气量:HCl>CH3COOH | D. | 放出氢气量:HCl=CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com