
 硫酸工业生产应考虑综合经济效益问题.
硫酸工业生产应考虑综合经济效益问题.| 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 | |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
分析 (1)硫酸工业生产应考虑综合经济效益问题,同时要考虑当地的需求量情况,硫酸厂是一座具有一定污染性的工厂;
(2)根据已知信息,确定出反应物和生成物,然后配平化学方程式;
(3)为了有利于SO2转化SO3,多采用装有多层催化剂的接触室作反应设备,让气体不直接进入该设备进行反应的原因是使热量能充分利用;
(4)在硫酸工业制法中,黄铁矿燃烧前需要粉碎,是为了增大与空气的接触面,加快反应速率;
从沸腾炉出来的炉气中含有SO2、O2、N2、水蒸气、灰尘、砷硒化合物等,由于砷硒化合物能导致催化剂失去催化活性,因此需净化;
(5)增大压强后,SO2的平衡转化率提高得并不多,加压对设备的要求高且耗能多,将增大投资和能量消耗,400℃作为操作温度,因为在这个温度,催化剂的活性(反应速率)和SO2的平衡转化率都比较理想;
(6)根据SO2为酸性氧化物,与碱反应生成盐和水;
(7)98%的浓H2SO4中H2SO4、H2O的物质的量之比为$\frac{98g}{98g•mo{l}^{-1}}$:$\frac{2g}{18g•mo{l}^{-1}}$=1:$\frac{1}{9}$,故98%的浓H2SO4可以表示为SO3•$\frac{10}{9}$H2O,吸收SO3后得到H2SO4•SO3,可以表示为2SO3•H2O,进一步表示为$\frac{20}{9}$SO3•$\frac{10}{9}$H2O,计算浓硫酸改写后H2O的物质的量,可得$\frac{20}{9}$SO3•$\frac{10}{9}$H2O的物质的量,再利用硫原子守恒计算H2SO4•$\frac{1}{9}$H2O的物质的量,进而计算其质量.
解答 解:(1)A.硫酸厂厂址的选择综合经济效益考虑,硫酸产品的运输成本要高于原料黄铁矿的运输成本,故A错误;
B.风光秀丽的旅游城市,不靠近原料基地,也不靠近消耗硫酸的工业城市,导致原料运输与产品运输成本高,同时还会对旅游城市造成污染,故B错误;
C.由于硫酸产品的运输成本要高于原料黄铁矿的运输成本,所以厂址应选择在消耗硫酸甚多的工业城市,故C正确;
D、人口稠密的文化、商业中心城市,远离原料基地和消耗硫酸的工业城市,同时为了防止污染环境,不宜考虑作为硫酸厂厂址,故D错误;
故答案为:C;
(2)根据题意可知,高温煅烧时CuFeS2时,反应物为CuFeS2和O2,生成物为CuO、Fe2O3 和SO2,再根据化合价升降法配平氧化还原反应方程式,
故答案为:4CuFeS2+13O2 $\frac{\underline{\;高温\;}}{\;}$4CuO+2Fe2O3+8SO2;
(3)为了有利于SO2转化SO3,多采用装有多层催化剂的接触室作反应设备,让气体不直接进入该设备进行反应的原因是使热量能充分利用,
故答案为:接触室;使热量能充分利用;
(4)A.在硫酸工业制法中,黄铁矿燃烧前需要粉碎,是为了增大与空气的接触面,加快反应速率,不是因为大块的黄铁矿不能在空气中燃烧,故A错误;
B.从沸腾炉出来的炉气中含有SO2、O2、N2、水蒸气、灰尘、砷硒化合物等,由于砷硒化合物能导致催化剂失去催化活性,因此需净化,不是因为炉气中二氧化硫会与杂质反应,故B错误;
C.二氧化硫氧化为三氧化硫时需使用催化剂,目的是加快反应速率,提高产量.并不能提高二氧化硫的转化率,故C错误;
D.在吸收塔中三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率,故D正确;
故答案为:D;
(5)增大压强后,SO2的平衡转化率提高得并不多,加压对设备的要求高且耗能多,将增大投资和能量消耗.400℃作为操作温度,因为在这个温度,催化剂的活性(反应速率)和SO2的平衡转化率都比较理想,故选择400℃、1个大气压,
故答案为:400℃、1个大气压;
(6)SO2为酸性氧化物,与碱反应生成盐和水,化学方程式为:2NH3•H2O+SO2=(NH4)2SO3+H2O,
故答案为:2NH3•H2O+SO2=(NH4)2SO3+H2O;
(7)98%的浓H2SO4中H2SO4、H2O的物质的量之比为$\frac{98g}{98g•mo{l}^{-1}}$:$\frac{2g}{18g•mo{l}^{-1}}$=1:$\frac{1}{9}$,故98%的浓H2SO4可以表示为SO3•$\frac{10}{9}$H2O,吸收SO3后得到H2SO4•SO3,可以表示为2SO3•H2O,进一步表示为$\frac{20}{9}$SO3•$\frac{10}{9}$H2O,计算浓硫酸改写后H2O的物质的量,可得$\frac{20}{9}$SO3•$\frac{10}{9}$H2O的物质的量,浓硫酸改写后H2O的物质的量为n(H2O)=1000g÷(80+$\frac{10}{9}$×18)×$\frac{10}{9}$=$\frac{100}{9}$mol,则$\frac{20}{9}$SO3•$\frac{10}{9}$H2O的物质的量为10mol,根据硫原子守恒,稀释后可得浓硫酸H2SO4•$\frac{1}{9}$H2O的质量为$\frac{200}{9}$mol×(98+2)g/mol=2222g,约是2.22Kg,
故答案为:C.
点评 本题考查了工业制硫酸的生成过程和反应特征,二氧化硫的催化氧化反应的条件选择,化学方程式的书写,以及有关计算,题目过程复杂,为易错题目,关键是明确浓硫酸中水与三氧化硫反应转化为硫酸,注意理解利用改写成化学式形式结合守恒进行解答,难度中等.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:解答题
 第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 | 编号 | 实验温度/℃ | 药品 | |
| Ⅰ | ① | 25 | 铝条 | 盐酸5ml3mol•L-1 |
| ② | 25 | 铝条(规格同上) | 盐酸5ml0.5mol•L-1 | |
| Ⅱ | ① | 25 | 碳酸钙粉末 | 盐酸5ml3mol•L-1 |
| ② | 25 | 块状碳酸钙 | 盐酸5ml3mol•L-1 | |
| Ⅲ | ① | 5 | 二氧化氮与四氧化二氮的混合气体 | |
| ② | 35 | 二氧化氮与四氧化二氮的混合气体 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
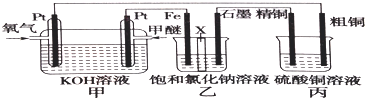
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属原子的核外电子在金属晶体中都是自由电子 | |
| B. | 金属导电的实质是金属阳离子在外电场作用下的定向移动 | |
| C. | 金属原子在化学变化中失去的电子数越多,其还原性越强 | |
| D. | 体心立方晶胞和面心立方晶胞中实际含有的原子个数之比为1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com